微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中
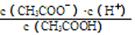 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
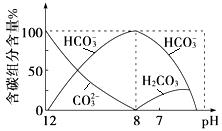
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
填空题 (10分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中
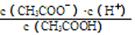 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0 .1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
本题答案:(1)不变(1分)c(CH3COO-)+c(OH-)=c(H
本题解析:
试题分析:(1)电离平衡常数Ka=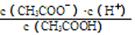 ,只受温度的影响,温度不变Ka不变;电解质溶液中电荷守恒式c(CH3COO-)+c(OH-)=c(H+)+c(Na+)中含有溶液中的所有离子。
,只受温度的影响,温度不变Ka不变;电解质溶液中电荷守恒式c(CH3COO-)+c(OH-)=c(H+)+c(Na+)中含有溶液中的所有离子。
(2)Na2CO3为强碱弱酸盐水解呈碱性,加入石膏(CaSO4?2H2O)生成碳酸钙沉淀,使CO32-浓度降低,水解平衡左移,c(OH-)减小,土壤碱性降低。(3).常温下向Na2CO3溶液中逐滴加入HCl溶液反应顺序为:
Na2CO3+HCl=NaHCO3+ NaCl
NaHCO3+HCl=NaCl+CO2↑+H2O
在同一溶液中,因CO2+H2O +CO32-=2 HCO3-,所以H2CO3、HCO3-、CO32-不能大量共存;
由图象可知,当pH=7时,碳元素存在于HCO3-、H2CO3中,且c(HCO3-)>c(H2CO3),根据c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)及c(H+)=c(OH-)可得c(Na+)>c(Cl-),又由于HCO3-水解c(Cl-)>c(HCO3-),所以主要的三种离子大小顺序为c(Na+)>c(Cl-)>c(HCO3-)。
考点:了解弱电解质在水溶液中的电离平衡。了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
He that makes a thing too fine, breaks it. 做事过于苟求,反把事情弄坏。