|
|
|
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混【盐类水解的原理】
2016-12-25 17:20:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是 &#来源:91考试网 91EXAm.org160; (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(选填“>”、“<”、或“=”)
(3)求出混合液的下列算式的精确计算结果(填具体数字):c(Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液是中性,又知将HA溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH 7(选填“>”、“<”或“=”);
(5)将相同温度下浓度相同的四种盐溶液:
A.NH4HCO3
B.NH4A
C.(NH4)2SO4
D.NH4Cl
| 按pH由大到小的顺序排列 (填序号)
填空题 25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(选填“>”、“<”、或“=”)
(3)求出混合液的下列算式的精确计算结果(填具体数字):c(Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液是中性,又知将HA溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH 7(选填“>”、“<”或“=”);
(5)将相同温度下浓度相同的四种盐溶液:
A.NH4HCO3
B.NH4A
C.(NH4)2SO4
D.NH4Cl
|
按pH由大到小的顺序排列
(填序号)
本题答案:(1)A-+H2O
若HA是强酸,则恰好生成强酸强碱盐,溶液显中性,而溶液PH=8,说明溶液显碱性,生成的是强碱弱酸盐,水解显碱性。(2)盐类水解促进水的电离,酸、碱都能抑制水的电离,所以混合溶液中由水电离出的c(H+)>0.1 mol·L-1,NaOH溶液中由水电离出的c(H+)。(3)本小题考查的是电荷守恒问题和有关pH的计算,c(Na+)+c(H+)=c(OH-)+ c(A),所以c(Na+)-c(A)=c(OH)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1。根据质子守恒A-+H2O<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=)
HA+OH-和H2O
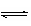
H++OH-可知OH-有两个来源,c(OH-)= c(H+)+ c(HA),c(OH-)-c(HA)=c(H+)=1×10-8mol·L-1。(4)已知将HA溶液加到Na2CO3溶
来源:91 考试网液中有气体放出,说明HA比H2CO3的酸性强,HA比H2CO3的电离程度大,NH4A溶液呈中性,HA的电离程度与氨水的电离程度相当,所以氨水的电离程度比H2CO3的电离程度大,(NH4)2CO3溶液的pH>7。(5)根据水解规律可知H2CO3的电离程度最弱,故NH4HCO3溶液显碱性,其pH最大,NH4A 溶液显中性,H2SO4、HCl都是强酸溶液显酸性,但(NH4)2SO4中c(NH4+)的值大,酸性最强,pH最小。
考点:盐类水解,
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
Action is the proper fruit of knowledge. 行动是知识的佳果.
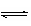 H++OH-可知OH-有两个来源,c(OH-)= c(H+)+ c(HA),c(OH-)-c(HA)=c(H+)=1×10-8mol·L-1。(4)已知将HA溶液加到Na2CO3溶来源:91 考试网液中有气体放出,说明HA比H2CO3的酸性强,HA比H2CO3的电离程度大,NH4A溶液呈中性,HA的电离程度与氨水的电离程度相当,所以氨水的电离程度比H2CO3的电离程度大,(NH4)2CO3溶液的pH>7。(5)根据水解规律可知H2CO3的电离程度最弱,故NH4HCO3溶液显碱性,其pH最大,NH4A 溶液显中性,H2SO4、HCl都是强酸溶液显酸性,但(NH4)2SO4中c(NH4+)的值大,酸性最强,pH最小。
H++OH-可知OH-有两个来源,c(OH-)= c(H+)+ c(HA),c(OH-)-c(HA)=c(H+)=1×10-8mol·L-1。(4)已知将HA溶液加到Na2CO3溶来源:91 考试网液中有气体放出,说明HA比H2CO3的酸性强,HA比H2CO3的电离程度大,NH4A溶液呈中性,HA的电离程度与氨水的电离程度相当,所以氨水的电离程度比H2CO3的电离程度大,(NH4)2CO3溶液的pH>7。(5)根据水解规律可知H2CO3的电离程度最弱,故NH4HCO3溶液显碱性,其pH最大,NH4A 溶液显中性,H2SO4、HCl都是强酸溶液显酸性,但(NH4)2SO4中c(NH4+)的值大,酸性最强,pH最小。