|
|
|
根据下表提供的数据,下列判断正确的是<img src="http://www【盐类水解的原理】
2016-12-25 17:23:35
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 根据下表提供的数据,下列判断正确的是
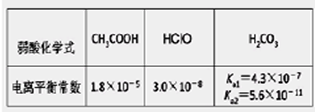
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: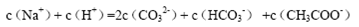
B.常温下,已知来源:91考试网 91exam.org酸H2A存在如下平衡: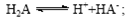 ; ;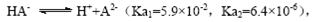 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
|
选择题 根据下表提供的数据,下列判断正确的是

A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: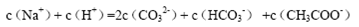
B.常温下,已知酸H2A存在如下平衡: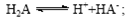 ; ;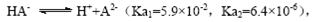 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
|
本题答案:D
本题解析:
试题分析:A、根据电荷守恒规律,等物质的量的Na2CO3和CH3COOH两种溶液混合一定有c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)+ c(HCO3-)+2 c(CO32-),错误;B、H2A为二元弱酸,则NaHA溶液的酸碱性未知,HA-的水解与电离程度的强弱无法判断,所以NaHA溶液中水的电离程度与纯水中水的电离程度无法比较,错误;C、 根据电离平衡常数可知,醋酸的酸性大于次氯酸,所以同浓度的醋酸钠与次氯酸钠的混合液中次氯酸根离子的水解程度大于醋酸根离子的水解程度,溶液呈碱性,则溶液 中离子的浓度关系是c(Na+)> c(CH3COO-)> c(ClO-)> c(OH-)>c(H+),错误;D、常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当 c(CH3COOH):c(CH3COO-)=5:9时,根据醋酸的电离常数K=1.8×10-5= c(CH3COO-)c(H+)/ c(CH3COOH),则c(H+)=1×10-5mol/L,所以溶液的pH=5,正确,答案选D。
考点:考查电解质溶液中离子浓度的关系比较,电离常数的应用
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
It matters not how a man dies,but how he lives. 一个人如何死是无关紧要的,重要的是如何生.