|
|
|
常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmo【盐类水解的原理】
2016-12-25 17:33:30
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示。下列有关说法正确的是
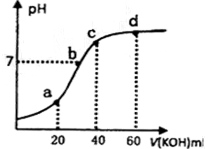
A.a点溶液呈酸性,是因为HC2O4-的电离程度小于其水解程度
B.b点:c(K+)=c(H2C2O4-)+2c(C2O42-)
C.c点:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
D.d点:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
| 91eXaM.org
选择题 常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示。下列有关说法正确的是

A.a点溶液呈酸性,是因为HC2O4-的电离程度小于其水解程度
B.b点:c(K+)=c(H2C2O4-)+2c(C2O42-)
C.c点:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
D.d点:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
|
本题答案:B
本题解析:
试题分析:A.a点溶液二者恰好反应产生KHC2O4,溶液中同时存在HC2O4-的电离作用和水解作用,电离是溶液显酸性,水解使溶液显碱性。而a碘溶液呈酸性是因为HC2O4?的电离程度大于其水解程度,错误 ;B.b点时溶液是KHC2O4和K2C2O4的混合物。溶液呈中性,即有c(H+)=c(OH?),根据电荷守恒有c(K+)+c(H+)=c(HC2O4?)+2c(C2O42?)+c(OH?),故有c(K+)=c(HC2O4?)+2c(C2O42?),正确;c点是草酸与KOH恰好中和反应生成K2C2O4,根据物料守恒有c(K+)=2c(H2C2O4)+2c(HC2O4?)+2c(C2O42?),错误;D.d点是反应后得到的等物质的量的K2C2O4和KOH的混合液,由于C2O42?水解消耗,同时还产生OH?,应是c(OH?)>c(C2O42?),错误。
考点:考查酸碱混合溶液中离子浓度大小比较的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
Dry bread at home is better than roast meat abroad. 在外吃烤肉不如在家啃面包.