微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
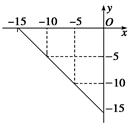
(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反 91exam.org应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃)
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强(kPa)
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度
(×10-3mol/L)
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
|
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
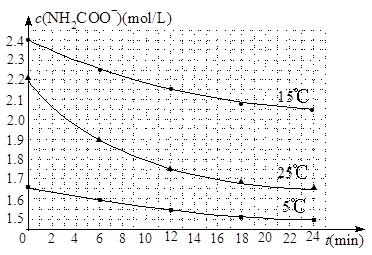
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
实验题 (10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)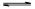 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃)
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强(kPa)
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度
(×10-3mol/L)
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
|
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 & 91eXaM.org#160; 。
(2)已知:NH2COONH4+2H2O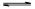 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
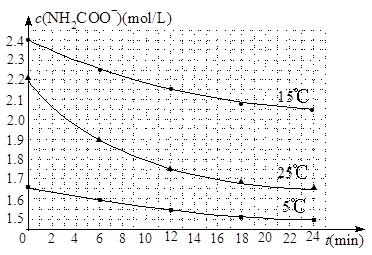
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
本题答案:I.(4分)(1)7.5 (2分) &
本题解析:I.(1)根据图像可知该温度下水的离子积常数是1×10-15,该温度下,中性溶液的pH=7.5。
(2)0.01 mol/L NaOH溶液OH-的浓度是0.01mol/L,所以氢离子是1×10-13mol/L,因此pH=13。
II.(1)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。不正确,不满足速率之比是相应的化学计量数之比。反应前后体积是变化的,所以压强也是变化的,因此B可以说明。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以C正确。由于只有生成物是气体,所以氨气的分数始终是不变的,D不正确,答案选BC。
②根据数据可知,平衡时氨气是0.0048mol/L÷3×2=0.0032mol/L,所以CO2是0.0016mol/L,因此平衡常数是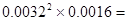 1.6×10-8(mol·L-1)3。
1.6×10-8(mol·L-1)3。
(2)③25℃时,0~6min氨基甲酸铵的浓度减小了2.2mol/L-1.9mol/L=0.3mol/L,所以反应速率是0.3mol/L÷6min=0.05mol·L-1·min-1。
④根据图像可知,25℃反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大。这说明水解反应的平均速率随温度升高而增大。
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
Action is the proper fruit of knowledge. 行动是知识的佳果.