|
|
|
25℃时对于pH=1的盐酸,下列叙述不正确的是A.c(H+)=c(Cl-【水的电离平衡】
2016-12-25 18:27:15
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 25℃时对于pH=1的盐酸,下列叙述不正确的是
A.c(H+)=c(Cl-)+c(OH-)
B.c(H+)·c(OH-)=1.0×10—14
C.由水电离出的c(H+)=1.0×10-13mol?L-1
D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性
|
选择题 25℃时对于pH=1的盐酸,下列叙述不正确的是
A.c(H+)=c(Cl-)+c(OH-)
B.c(H+)·c(OH-)=1.0×10—14
C.由水电离出的c(H+)=1.0×10-13mol?L-1
D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性
|
本题答案:D
本题解析:
试题分析:A、根据电荷守恒可知盐酸溶液中 存在c(H+)=c(Cl-)+c(OH-),A正确;B、在任何酸碱盐的稀溶液中氢离子浓度与OH-浓度之积均是常数,即25℃时c(H+)·c(OH-)=1.0×10—14,B正确;C、盐酸是强酸,抑制水的电离。溶液中由水电离出的c(H+)=c(OH-)=
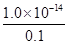
=1.0×10-13mol?L-1,C正确;D、与pH=13的NaOH溶液混合后,由于不能确定酸碱的体积,因此不能确定反应后溶液的酸碱性,所以混合溶液不一定呈中性,D不正确,答案选D。
考点:考查离子浓度关系、溶液酸碱性、水的离子积常数计算以及外界条件对水电离平衡的影响
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Great minds think alike. 英雄所见略同。
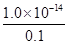 =1.0×10-13mol?L-1,C正确;D、与pH=13的NaOH溶液混合后,由于不能确定酸碱的体积,因此不能确定反应后溶液的酸碱性,所以混合溶液不一定呈中性,D不正确,答案选D。
=1.0×10-13mol?L-1,C正确;D、与pH=13的NaOH溶液混合后,由于不能确定酸碱的体积,因此不能确定反应后溶液的酸碱性,所以混合溶液不一定呈中性,D不正确,答案选D。