|
用0.10 mol/L 的盐酸滴定0.10 mol/L 的氨水,滴定过程中不可能出【水的电离平衡】
选择题 用0.10 mol/L 的盐酸滴定0.10 mol/L 的氨水,滴定过程中不可能出现的结果是 | A.c(NH4+)>c(Cl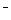 ),c(OH ),c(OH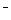 )>c(H )>c(H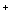 ) ) | B.c(NH4+) = c(Cl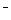 ),c(OH ),c(OH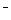 ) = c(H ) = c(H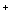 ) ) | |||||
C.c(Cl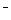 )>c(NH4+),c(OH )>c(NH4+),c(OH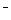 )>c(H )>c(H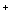 ) ) | D.c(Cl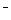 )>c(NH4+),c(H )>c(NH4+),c(H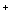 )>c(OH )>c(OH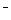 ) ) |
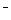 )>c(NH4+),c(H
)>c(NH4+),c(H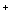 )>c(OH
)>c(OH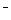 ),D项可能;随着氨水的增加,当溶液呈中性时:c(NH4+) = c(Cl
),D项可能;随着氨水的增加,当溶液呈中性时:c(NH4+) = c(Cl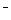 ),c(OH
),c(OH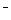 ) = c(H
) = c(H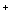 ),B项可能,继续 滴加氨水,离子浓度为:c(NH4+)>c(Cl
),B项可能,继续 滴加氨水,离子浓度为:c(NH4+)>c(Cl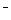 ),c(OH
),c(OH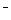 )>c(H
)>c(H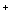 );不可能 为C项, c(Cl
);不可能 为C项, c(Cl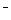 )>c(NH4+),c(OH
)>c(NH4+),c(OH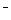 )>c(H
)>c(H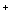 ),负电荷总数大于正电荷总数,违背了溶液呈中性的规律。
),负电荷总数大于正电荷总数,违背了溶液呈中性的规律。本题所属考点:【水的电离平衡】
本题难易程度:【一般】
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:25℃时,a mol·L-1一元酸HA溶液.. | ||