微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号) 。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 & #160; 。
填空题 (1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号) 。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 。
本题答案:(1) V(酸):V(碱)=1:100
本题解析:
试题分析:(1)常温下某强酸溶液pH=a,则溶液中氢离子浓度是10-amol/L。强碱溶液pH=b,则溶液中OH-浓度是10b-14mol/L。已知酸碱溶液混合pH=7,则V(酸)×10-amol/L=V(碱)×10b-14mol/L。又因为a+b=12,所以V(酸):V(碱)=10a+b-14=10-2=1:100。
(2)氢氧化钡是二元强碱,则溶液中OH-浓度是0.2mol/L;醋酸是弱酸,存在电离平衡,则溶液中氢离子浓度是小于0.1mol/L;氢氧化钠是一元强碱,则溶液中OH-浓度是0.1mol/L;盐酸是一元强酸,则溶液中氢离子浓度是0.1mol/L。一元酸电离出的氢离子或碱电离出的OH-抑制水的电离,且氢离子或OH-浓度越大,抑制程度越大。因此四种溶液中由水电离出的OH—浓度由大到小的顺序是②>③=④>①。
(3)已知100℃ KW=10-12,则此温度下pH=8的Ba(OH)2溶液中OH-浓度是10-4mol/L。pH=5的稀盐酸溶液中氢离子浓度是10-5mol/L,如果混合后溶液的pH=7,这说明碱是过量的,所以有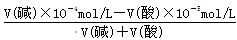 =10-5mol/L,解得V(碱):V(酸)=2:9。
=10-5mol/L,解得V(碱):V(酸)=2:9。
考点:考查水的电离、溶液pH的计算
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
We soon believe what we desire. 心里想什么就会相信什么。