|
|
|
常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol?【水的电离平衡】
2016-12-25 18:39:10
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下 列说法正确的是
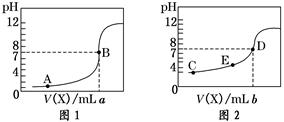
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙
|
选择题 常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是

A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙
|
本题答案:C
本题解析:
试题分析:A.图2在开始滴定时溶液的pH=3,而盐酸是强酸,完全电离,0.10 mol·L-1 HCl的pH=1,与实际情况不符合,所以这是滴定醋酸的曲线,错误;B.由于盐酸与醋酸的浓度相等,体积相同,所以当滴定达到溶液d的pH=7时,a与b的关系是:a>b,错误;C.在E点时溶液为酸性溶液,对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-),正确;D.用碱滴定酸时,为了减小滴定误差,应该选择溶液的颜色由浅到深
来源:91考试网 91ExaM.org的的变化的酚酞作指示剂,颜色变化为无色变红色,错误;
考点:考查酸碱中和滴定时的滴定曲线、消耗溶液的体积、离子浓度的大小比较、和指示剂的选择的知识。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Good temper is like a sunny day; it sheds its brightness everywhere. 好情绪犹如明媚的阳光,普照四方。