微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。

①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3 )有同学提出“步骤二”没有必要,请你简述自己的看法 。
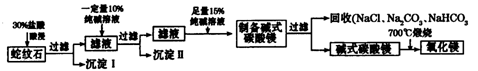
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。

①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查 整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:

(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
本题答案:I.(1)①a+NaOH====NaHCO3,NaOH+NaHCO3====Na2CO3+H2O。(1)分析题给装置知,A为二氧化碳的发生装置,B中发生二氧化碳与氢氧化钠溶液的反应,C装置除去二氧化碳中的氯化氢;①为制得纯净的碳酸氢钠溶液,要先除去二氧化碳中的氯化氢,各装置正确的连接顺序为a<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) d
d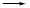 c
c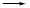 b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
Ⅱ.根据题给流程分析,蛇纹石用30%盐酸酸浸,MgO、CaO、Fe2O3、Al2O3和盐酸反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O;而SiO2不与盐酸反应,过滤得沉淀Ⅰ为二氧化硅,滤液为MgCl2、CaCl2、FeCl3、AlCl3和盐酸的混合液,向滤液中加入一定量10%纯碱溶液,Ca2+、Fe3+、Al3+和碳酸钠溶液反应转化为氢氧化铁、氢氧化铝和碳酸钙沉淀经过滤而除去,反应方程式为CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;向滤液中加足量15%纯碱溶液制得碱式碳酸镁,过滤,回收氯化钠、碳酸钠和碳酸氢钠,碱式碳酸镁煅烧得氧化镁。(1)过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。(2)根据上述分析知,沉淀Ⅱ的成分为CaCO3、Fe(OH)3、Al(OH)3,用离子方程式表示生成沉淀的过程CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;(3)纯碱溶液中所有离子浓度的大小关系为c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。(4)利用公式c=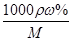 将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
考点:考查化学实验基本操作,物质的制备方案的设计、评价,物质的的分离提纯,离子方程式的书写,离子浓度大小比较,物质的量浓度的计算。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Bear with evil,and expect good. 坏事要忍,好事要等。