微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液 91eXAm.org滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
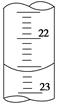
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
滴定次数
| 待测液体积(mL)
| 标准NaOH溶液读数记录(mL)
|
滴定前读数
| 滴定后读数
|
第一次
| 20.00
| 0.40
| 20.40
|
第二次
| 20.00
| 4.00
| 24.00
|
第三次
| 20.00
| 2.00
| 24.10
|
实验题 某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
滴定次数
| 待测液体积(mL)
| 标准NaOH溶液读数记录(mL)
|
滴定前读数
| 滴定后读数
|
第一次
| 20.00
| 0.40
| 20.40
|
第二次
| 20.00
| 4.00
| 24.00
|
第三次
| 20.00
| 2.00
| 24.10
|
本题答案:(1)① 偏大
(2) 无 粉红
(3)22.60
本题解析:(1)①用蒸馏水洗涤碱式滴定管后,不能立即注入NaOH溶液,应先用NaOH溶液润洗;否则所用NaOH溶液的体积偏大,导致测定盐酸的浓度偏大。(2)酚酞试剂在酸性溶液中呈无色,当溶液呈弱碱性时,溶液呈粉红色。(4)取前两次所用NaOH溶液体积的平均值(第三次误差较大,舍去),然后代入公式进行计算:c(酸)V(酸)=c(碱)V(碱),故c(酸)=c(碱)V(碱)/V(酸)。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Eternal vigilance is the price of liberty. 自由的代价是永远警惕。