微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 Ⅰ(8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol?L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据判断PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
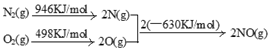
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又来源:91考试网 91ExaM.org能制得氢气,具体流程如下:
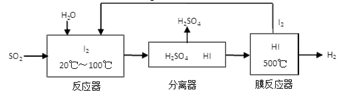
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _
Ⅱ(10分)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为: 蒸发浓缩、冷却结晶、 、洗涤。
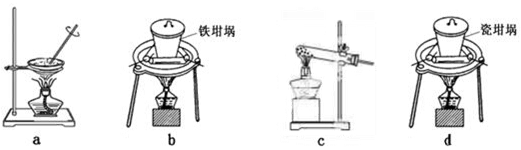
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
填空题 Ⅰ(8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol?L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据判断PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
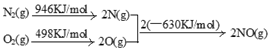
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _
Ⅱ(10分)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为: 蒸发浓缩、冷却结晶、 、洗涤。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。

本题答案:Ⅰ(8分)(1)pH="4" 。
(2)N2(g)+O
本题解析:
试题分析:(1)溶液呈电中性,则n(H+)+n(K+)+n(Na+)+n(NH4+)=2n(SO42-)+n(NO3-)+n(Cl-)。所以c(H+)+ 4×10-6+6×10-6+2×10-5=2×4×10-5+3×10-5+2×10-5。解得c(H+)=1 91Exam.org×10-4,所以pH=4;(2)根据题意N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)= 2NO(g) △H="(946KJ/mol" +498KJ/mol— 2×630 KJ/mol)=+184kJ/mol;(3)①在反应器中SO2、I2、H2O发生反应产生硫酸和氢碘酸。用离子方程式表示为SO2+I2+2H2O=SO42-+2I-+4H+;②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,通入氢气的电极是负极,负极的电极反应式是H2-2e-+2OH-=2H2O;Ⅱ(1)检验滤液B中是否还含有铁元素的方法为取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B 中不含铁元素。(2)由于在滤液B中的铝元素以Al3+形式存在,若使Al3+以沉淀形式析出,由于Al(OH)3是两性物质,既可以与强酸反应液可以与强碱发生反应,所以应该用弱碱,可选用的最好试剂为氨水,选项是C;(3)由滤液B制备氯化铝晶体涉及的操作为:加入浓盐酸蒸发浓缩、冷却结晶、过滤、洗涤,就得到了氯化铝晶体。(4)SiO2和NaOH焙烧制备硅酸钠,由于NaOH是强碱,能够与玻璃、陶瓷中的SiO2发生反应,所以应该用铁坩埚,可采用的装置为B。
考点:考查溶液的酸碱性、热化学方程式的书写、铁元素的检验、试剂的使用、仪器的选择的知识。
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
The more we study, the more we discover our ignorance. 读书越多,越感到学识不足.