|
|
|
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴?【水的电离平衡】
2016-12-25 19:05:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是
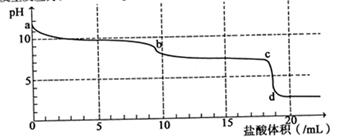
A.a点时溶液pH=11.5,原 因是:CO32-+H2O=HCO3-+OH-
B.a-b段发生反应为:CO32-+2H+=CO2↑+H2O
C.b-c段发生反应为:HCO3-+H+=CO2↑+H2O
D.c-d段发生反应为:H++OH-=H2O
|
选择题 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是

A.a点时溶液pH=11.5,原因是:CO32-+H2O=HCO3-+OH-
B.a-b段发生反应为:CO32-+2H+=CO2↑+H2O
C.b-c段发生反应为:HCO3-+H+=CO2↑+H2O
D.c-d段发生反应为:H++OH-=H2O
|
本题答案:C
本题解析:
试题分析:A、碳酸根离子水解是可逆反应,所以不能用“=”表示,错误;B、碳酸钠溶液中逐滴滴入稀盐酸时,先发生CO32-+H+= HCO3-,a-b段溶液的pH基本不变,说明此时发生的是CO32-+H+= HCO3-,错误;C、bc段的pH降低,说明此时发生的是HCO3-+H+=CO2↑+H2O,正确;D、当稀盐酸与碳酸钠反应完全时,溶液应呈中性,但二氧化碳能溶于水,生成的碳酸电离产生氢离子,使溶液呈酸性,所以c-d段溶液由中性变为酸性的原因是二氧化碳溶于水的缘故,错误,答案选C。
考点:考
来源:91exam .org查对图像的分析,离子方程式的判断
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
He who laughs at crooked men should need walk very straight. 讥笑别人驼背的人,自己先得挺直身子。