|
|
|
室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中?【水的电离平衡】
2016-12-25 19:05:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是
A.水电离出的OH-浓度:10c(OH-)甲 ≤ c(OH-)乙
B.溶液的体积:10V甲 ≤ V乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲 ≤ 乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲 ≥ 乙
|
选择题 室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是
A.水电离出的OH-浓度:10c(OH-)甲 ≤ c(OH-)乙
B.溶液的体积:10V甲 ≤ V乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲 ≤ 乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲 ≥ 乙
|
本题答案:B
本题解析:
试题分析:酸溶液中的氢氧根离子是水电离的,则pH=3的酸中,水电离的氢氧根离子浓度为,c(OH-)=
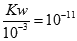
pH=4的酸中,水电离的氢氧根离子浓度为10-10mol/L,水电离出的OH-浓度:10c(OH-)甲 =c(OH-)乙,故A错误;B.若酸为强酸,则依据溶液吸稀释过程中氢离子浓度不变5ml×10-3=V×10-4,解得V=5Oml,则10V甲=V乙,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,所以10V甲≤V乙,故B正确;C.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度甲>乙,若酸为强酸,则二者的pH相等,若酸为弱酸,则甲溶液的pH大于乙,即:甲≥乙,故C错误;D.若酸是强酸,分别与5mL pH=11的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,pH值相等,若为弱酸,则反应后酸有剩余,甲中剩余酸浓度大,酸性强,pH小,所得溶液的pH:甲≤乙,故D错误;故选B.
考点:电离平衡与PH计算
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Gratitude is the least of virtues; ingratitude the worst of vices. 感恩是小德;忘恩是大恶。
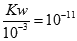 pH=4的酸中,水电离的氢氧根离子浓度为10-10mol/L,水电离出的OH-浓度:10c(OH-)甲 =c(OH-)乙,故A错误;B.若酸为强酸,则依据溶液吸稀释过程中氢离子浓度不变5ml×10-3=V×10-4,解得V=5Oml,则10V甲=V乙,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,所以10V甲≤V乙,故B正确;C.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度甲>乙,若酸为强酸,则二者的pH相等,若酸为弱酸,则甲溶液的pH大于乙,即:甲≥乙,故C错误;D.若酸是强酸,分别与5mL pH=11的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,pH值相等,若为弱酸,则反应后酸有剩余,甲中剩余酸浓度大,酸性强,pH小,所得溶液的pH:甲≤乙,故D错误;故选B.
pH=4的酸中,水电离的氢氧根离子浓度为10-10mol/L,水电离出的OH-浓度:10c(OH-)甲 =c(OH-)乙,故A错误;B.若酸为强酸,则依据溶液吸稀释过程中氢离子浓度不变5ml×10-3=V×10-4,解得V=5Oml,则10V甲=V乙,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,所以10V甲≤V乙,故B正确;C.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度甲>乙,若酸为强酸,则二者的pH相等,若酸为弱酸,则甲溶液的pH大于乙,即:甲≥乙,故C错误;D.若酸是强酸,分别与5mL pH=11的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,pH值相等,若为弱酸,则反应后酸有剩余,甲中剩余酸浓度大,酸性强,pH小,所得溶液的pH:甲≤乙,故D错误;故选B.