|
|
|
(10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的【水的电离平衡】
2016-12-25 19:09:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
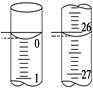
| (3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数
| 待测NaOH溶液的体积/mL
| 0.100 0 mol·L-1盐酸的体积/mL
| 滴定前刻度
| 滴定后刻度
| 溶液体积/mL
| 第一次
| 25.00
| 0.00
| 26.11
| 26.11
| 第二次
| 25.00
| 1.56
| 30.30
| 28.74
| 第三 次
| 25.00
| 0.22
| 26.31
| 26.09
|
依据上表数据列式计算该NaOH溶液的物质的量浓度。(保留4位有效数字)
实验题 (10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
|
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数
| 待测NaOH溶液的体积/mL
| 0.100 0 mol·L-1盐酸的体积/mL
|
滴定前刻度
| 滴定后刻度
| 溶液体积/mL
|
第一次
| 25.00
| 0.00
| 26.11
| 26.11
|
第二次
| 25.00
| 1.56
| 30.30
| 28.74
|
第三次
| 25.00
| 0.22
| 26.31
| 26.09
|
依据上表数据列式计算该NaOH溶液的物质的量浓度。(保留4位有效数字)
本题答案:22 (1)锥形瓶中溶液颜色变化 在半分钟内不变色 (2)D
本题解析:
试题分析:(1)眼睛观察的是锥形瓶内指示剂颜色的变化,而不是滴定管中液体的体积变化;判断滴定终点时,注意在指示剂颜色发生变化后,半分钟内不再复原,停止滴定,答案为锥形瓶中溶液颜色变化 在半分钟内不变色;
(2) A.由于未用标准液润洗,导致消耗盐酸的体积比实际上要大,测定的氢氧化钠溶液的浓度偏高。B.无影响;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,直接导致读数比实际值偏大,使测定的氢氧化钠溶液的浓度偏高;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,导致读数比实际上偏小,使测定的氢氧化钠溶液的浓度偏低;选D。
(3)由图可知:滴定前刻度0.00,滴定后刻度26.10,溶液体积26.10;
(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积的平均值:V="(26.11+26.09)/2=" 26.10(mL),其浓度为0.100 0 mol/L,待测氢氧化钠溶液的体积为25.00 mL,则该氢氧化钠溶液的物质的量浓度c(NaOH)=c(盐酸)×V(盐酸) /V(NaOH)="0.104" 4 mol/L。
考点:考查酸碱中和滴定。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Live as long as you may, the first twenty years are the longest half of your life. 不管你活得多久,头二十年都是你一生中最长的一半.

