微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,有下列4种溶液,下列说法正确的是
①
| ②
| ③
| ④
|
0.1 mol·L-1
CH3COOH溶液
| pH=3 CH3COOH溶液
| 0.1 mol ·L- 1
NaOH溶液
| pH=11 NaOH溶液
|
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
选择题 常温下,有下列4种溶液,下列说法正确的是
①
| ②
| ③
| ④
|
0.1 mol·L-1
CH3COOH溶液
| pH=3 CH3COOH溶液
| 0.1 mol ·L-1
NaOH溶液
| pH=11 NaOH溶液
|
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
本题答案:D
本题解析:
试题分析:A.NaOH是强碱、CH3COOH是弱酸,它们都能使水的电离平衡H2O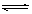 H++OH-左移,且前者使水的电离平衡左移的程度大于后者,导致水电离出的氢离子浓度更小,错误;B.根据稀释定律:c1·V1=c2·V2,则①稀释到原来的100倍后,醋酸的 浓度变为0.001mol·L-1,但是醋酸是弱酸,即使稀释100倍也不能完全电离,则溶液中氢离子浓度小于0.001 mol·L-1,由于pH=-lgc(H+),则溶液pH>3,不可能与②相同,错误;C.若①与③等体积混合,根据n=c·V可知,NaOH和CH3COOH恰好完全中和,得到的CH3COONa是强碱弱酸盐,混合后溶液呈弱碱性,pH>7,若溶液pH=7,则醋酸一定过量,因此V(NaOH)<V(CH3COOH),错误;D.若①与③等体积混合,醋酸远远过量,NaOH严重不足,若溶液pH=7,V(CH3COOH)< V(NaOH),正确。
H++OH-左移,且前者使水的电离平衡左移的程度大于后者,导致水电离出的氢离子浓度更小,错误;B.根据稀释定律:c1·V1=c2·V2,则①稀释到原来的100倍后,醋酸的 浓度变为0.001mol·L-1,但是醋酸是弱酸,即使稀释100倍也不能完全电离,则溶液中氢离子浓度小于0.001 mol·L-1,由于pH=-lgc(H+),则溶液pH>3,不可能与②相同,错误;C.若①与③等体积混合,根据n=c·V可知,NaOH和CH3COOH恰好完全中和,得到的CH3COONa是强碱弱酸盐,混合后溶液呈弱碱性,pH>7,若溶液pH=7,则醋酸一定过量,因此V(NaOH)<V(CH3COOH),错误;D.若①与③等体积混合,醋酸远远过量,NaOH严重不足,若溶液pH=7,V(CH3COOH)< V(NaOH),正确。
考点:考查弱电解质在水溶液中的电离平衡。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Working without a plan is sailing without a compass. 工作无计划等于航海无罗盘.