|
|
|
下列有关说法正确的是A.常温下,0.1 mol·L—1Na2S溶液中?【水的电离平衡】
2016-12-25 19:26:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列有关说法正确的是
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.等浓度的氨水和氯化铵按体积比2:3混合,溶液中存在:2c(Cl-)=3[ c(NH4+)+c(NH3.H2O)]
C.0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
D.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的值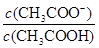 增大到原来的10倍 增大到原来的10倍
|
选择题 下列有关说法正确的是
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.等浓度的氨水和氯化铵按体积比2:3混合,溶液中存在:2c(Cl-)=3[c(NH4+)+c(NH3.H2O)]
C.0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(N a+)=c(A—)>c(OH—)=c(H+)
D.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的值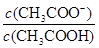 增大到原来的10倍 增大到原来的10倍
|
本题答案:D
本题解析:
试题分析:A、根据质子守恒得出:c(OH—)=c(H+) + c(HS—) +2c(H2S),错误;B、设浓度均为1mol/L,氨水的体积为2L,氯化铵的体积3L,根据N元素守恒:c(NH4+)+c(NH3.H2O)=1mol/L,c(Cl-)=0.6mol·L-1,因此5c(Cl-)=3[c(NH4+)+c(NH3.H2O)] ,错误;C、不知HA是强酸还是弱酸,若为强酸,c(Na+)=c(A—)>c(OH—)=c(H+),若为弱酸,c(Na+)>c(A—)>c(OH—)>c(H+),错误;D、根据电离平衡常数K=
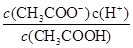
,推导出
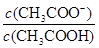
=c(H+)×K,pH从3.0升到4.0时,
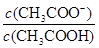
增大到原来的10倍,正确。
考点:考查离子浓度大小的比较及电离平衡常数。
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
Experience keeps no school; she teachs her pupils singly. 经验不由学校教,亲身实践才得到.
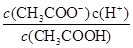 ,推导出
,推导出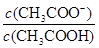 =c(H+)×K,pH从3.0升到4.0时,
=c(H+)×K,pH从3.0升到4.0时,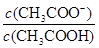 增大到原来的10倍,正确。
增大到原来的10倍,正确。