微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol?L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol?L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
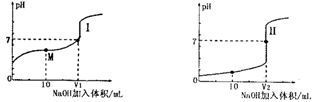
(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物 91exam.org的重要原料。下图为二水合草酸钴(CoC2O4?2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
填空题 (8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol?L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol?L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。

(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4?2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
本题答案:(8分)
I、(1)I (2)
本题解析:
试题分析:Ⅰ、(1)醋酸是弱酸,浓度为0.1 mol?L—1醋酸溶液的PH>1,所以滴定醋酸的曲线是I;
(2)NaOH、HCl、CH3COOH 的浓度相等,均为0.1 mol?L—1,NaOH、HCl属于强碱、强酸,CH3COOH 是弱酸,电离出的c(H+)的浓度较小,对水的电离程度抑制的小,所以滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是醋酸。
(3)当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,醋酸钠属于强碱弱酸盐,溶液显碱性,当两溶液呈中性时,向醋酸中滴加NaOH的体 积要少,所以V1 <V2 .
(4)M点是醋酸钠和醋酸的等浓度混合溶液,溶液显酸,醋酸的电离程度大于CH3COO-的水解程度,则M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-)。
Ⅱ、(1)由题意知,二水合草酸钴(CoC2O4?2H2O)的起始质量是18.3g,物质的量为0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量为8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g?mol-1=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1: 0.133125="3:4," C点剩余固体的化学成分为Co3O4,B点对应的物质的质量是14.70g,与起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与氧气在225 ℃~300 ℃发生反应的化学方程式为3CoC2O4+2O2 = Co3O4+6CO2;
(2)设该钴的氧化物中-3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48/22.4=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为 +2价,则-3价Co得到电子的物质的量是x=0.4,480mL5mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据氯元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4×3+0.6×2)÷2=1.2mol,所以钴氧化物中Co、O的物质的量之比5:6。
考点:考查酸碱中和滴定,草酸钴的化学性质等知识。
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
It is ill jesting with edged tools. 手持利器,不可打闹。