|
下列溶液中微粒的物质的量浓度关系正确的是A.常温下电离常?【水的电离平衡】
www.91exAm.org 选择题 下列溶液中微粒的物质的量浓度关系正确的是 |
 H++A-,c(H+)=
H++A-,c(H+)= 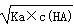 ,错误;B、反应后溶液中溶质:CH3COOH、CH3COONa,且两种物质的物质的量是相同,根据物料守恒得出:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两者合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确;C、有白色沉淀产生,只能说明此时溶液中的c(Ca2+)×c(SO42-)>Ksp(CaSO4),不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),错误;D、NH4HSO4和NaOH按1:1反应生成(NH4)2SO4、Na2SO4,溶液显酸性,按1:2反应Na2SO4、NH4·H2O,溶液显碱性,因此溶液显中性,若NH4HSO4是1mol,则NaOH的量应在1~2之间,NH4+水解,c(SO42-)>c(NH4+),因此浓度大小:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-),错误。
,错误;B、反应后溶液中溶质:CH3COOH、CH3COONa,且两种物质的物质的量是相同,根据物料守恒得出:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两者合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确;C、有白色沉淀产生,只能说明此时溶液中的c(Ca2+)×c(SO42-)>Ksp(CaSO4),不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),错误;D、NH4HSO4和NaOH按1:1反应生成(NH4)2SO4、Na2SO4,溶液显酸性,按1:2反应Na2SO4、NH4·H2O,溶液显碱性,因此溶液显中性,若NH4HSO4是1mol,则NaOH的量应在1~2之间,NH4+水解,c(SO42-)>c(NH4+),因此浓度大小:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-),错误。本题所属考点:【水的电离平衡】
本题难易程度:【困难】
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:(8分)下表是不同温度下水的离子.. | ||