|
|
|
常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.200【水的电离平衡】
2016-12-25 19:50:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解)。下列说法不正确的是
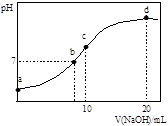
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(NH4+)+c(H+)+ c(Na www.91eXam.org+)=c(OH-)+2c(SO42-)
D.点d所示溶液中:c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1
|
选择题 常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解)。下列说法不正确的是
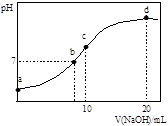
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(NH4+)+c(H+)+ c(Na+)=c(OH-)+2c(SO42-)
D.点d所示溶液中:c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1
|
本题答案:B
本题解析:
试题分析:(NH4)2SO4是强酸弱碱盐,其溶液显酸性,故点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-),A对,不选;NH4+水解是微弱的,所以溶液显中性时加入的NaOH溶液量是少量的,故c(NH4+)>c(Na+),B错,选B;c(NH4+)+c(H+)+ c
来源:91考试网 91ExaM.org(Na+)=c(OH-)+2c(SO42-)是电荷守恒,C对,不选;c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1是物料守恒,D对,不选。选B。
考点:盐类水解和离子浓度的大小比较。
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
Be it ever so humble, there is no place like home. 休嫌它寒微贫贱,天涯无处似家园.