微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,0.1 mol/L某一元酸(HA)溶液中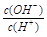 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的 91ExaM.orgc(H+)=10-10 mol/L
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
选择题 常温下,0.1 mo l/L某一元酸(HA)溶液中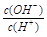 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的c(H+)=10-10 mol/L
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
本题答案:A
本题解析:常温下,水的离子积为1×10-14,结合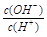 =1×10-8可得出,溶液中的
=1×10-8可得出,溶液中的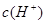 =1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA
=1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA H++OH—;
H++OH—;
A.溶液中加入一定量CH3COONa晶体,CH3COO—会结合溶液中的H+,使溶液中的c(H+)减少,c(OH-)必定增加;加水稀释,溶液酸性减弱,c(H+)减小,c(OH-)增大,符合题意
B.由上面的分析可知,溶液中的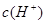 =c(A-)=1×10-3mol/L,错误
=c(A-)=1×10-3mol/L,错误
C.对于一元酸溶液来说,水电离出的c(H+)等于溶液中c(OH-),即10-11mol/L,排除
D.所给离子顺序,很明显违背了电荷守恒原则,排除。
故答案为A
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
There is ,however, a limit at which forbearance ceases to be a virtue. 克服也有个限度,超过了限度就不再是美德。