|
|
|
(8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为?【弱电解质电离平衡】
2016-12-25 20:13:33
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.5 4×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ;
碳酸的第一步电离比第二步电离 (填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > >
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A.c(CH3COO-)
B.c(H+)
C.醋酸的电离平衡常数
D.醋酸的电离度
|
填空题 (8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ;
碳酸的第一步电离比第二步电离 (填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > >
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A.c(CH3COO-)
B .c(H+)
C.醋酸的电离平衡常数
D.醋酸的电离度
|
本题答案:(1)
碳酸的第一步电离方程式为H2CO3<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=)
H++HCO3-,所以电离平衡常数表达式为Ka1 =
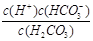
。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
History repeats itself. 历史往往重演。
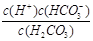 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。