微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
①
| HF
| Ka=6.8×10-4 mol?L-1
|
②
| CH3COOH
| Ka=1.7×10-5 mol?L-1
|
③
| HCN
| Ka=6.2×10-10 mol?L-1
|
④
| H2CO3
| Ka1=4.4×10-7mol?L-1
Ka2=4.7×10-11 mol?L-1
|
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是 、 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________ ______,
足量的CO2通入NaCN溶液中:_________ _____。
填空题 (12分)已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
①
| HF
| Ka=6.8×10-4 mol?L-1
|
②
| CH3COOH
| Ka=1.7×10-5 mol?L-1
|
③
| HCN
| Ka=6.2×10-10 mol?L-1
|
④
| H2CO3
| Ka1=4.4×10-7mol?L-1
Ka2=4.7×10-11 mol?L- 1
|
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是 、 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________ ______,
足量的CO2通入NaCN溶液中:_________ _____。
本题答案:(1)氢氟酸, HCN <
本题解析:(1)电离常数越大,相应酸的酸性越强,所以根据电离常数可知,酸性最强的是氢氟酸,而最弱的是HCN。
(2)碳酸是二元弱酸,电离是分步进行的,所以电离方程式依次是
H2CO3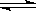 HCO3—+H+、HCO3—
HCO3—+H+、HCO3—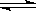 CO32—+H+。
CO32—+H+。
(3)由于氢氟酸的电离常数大于碳酸的电离常数,所以根据较强酸制取较弱的酸可知,反应的方程式是2HF+Na2CO3=2NaF+H2O+CO2↑;由于碳酸的第一步电离常数大于HCN的,但第二步小于HCN的,所以足量的CO2通入NaCN溶液中反应方程式是NaCN+H2O+CO2= HCN+NaHCO3。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
Distrust all in whom the impules to punish is powerful. 不要信任任何有强烈惩罚欲的人.