|
25 ℃时,电离平衡常数:<table border="1" cellpadding="0" c【弱电解质电离平衡】
2016-12-25 22:39:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 25 ℃时,电离平衡常数:
弱酸的化学式
| CH3COOH
| HClO
| H2CO3
| 电离平衡常数(25 ℃)
| 1.8×10-5
| 3.0×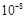
| K1=4.3×10-7
K2=5.6×10-11
|
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 & #160; ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ;

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
填空题 来源:91考试网 91ExaM.org25 ℃时,电离平衡常数:
弱酸的化学式
| CH3COOH
| HClO
| H2CO3
| 电离平衡常数(25 ℃)
| 1.8×10-5
| 3.0×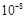
| K1=4.3×10-7
K2=5.6×10-11
|
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ;

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
本题答案:(1)a,b,d,c (2)A
(3)大于 稀释相同倍
本题解析:(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>HC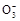 ,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a,b,d,c。 ,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a,b,d,c。
(2)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH、CH3COO-、H+浓度却都要减小,但c(OH-)却是增大的,且CH3COOH浓度减少最多,所以A减小,B增大,C不变,D增大。
(3)观察图示稀释100倍pH变化小于两个单位说明HX也为弱酸,pH变化大于醋酸pH变化,因此酸性大于醋酸,电离常数大于醋酸;稀释后c(H+)小于醋酸溶液中的c(H+),所以对水的电离抑制能力减小。
(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【困难】
Better the last smile than the first laughter. 宁可最后微笑,不要首先狂喜. |
|