|
|
|
(8分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲?【弱电解质电离平衡】
2016-12-25 23:05:06
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)一定温度下,冰醋 91eXaM.org酸加水稀释过程中溶液的导电能力变化曲线如图所示,
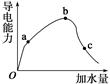
请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
| A.加热 | B.加很稀的NaOH溶液
| | C.加NaOH固体 | D.加水
| E.加入锌粒
填空题 (8分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,

请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
| A.加热 | B.加很稀的N aOH溶液
|
| C.加NaOH固体 | D.加水
|
E.加入锌粒
本题答案:18.(8分)(1)无自由移动的离子 (2)b&l
本题解析:
试题分析:(1)冰醋酸是纯净的醋酸,只有电解质分子,没有发生电离。没有自由移动的离子所以不能导电。(2)自由移动的离子浓度越大,溶液的导电性就越强,由于导电性b>a>c,所以氢离子的浓度大小顺序是:b>a>c。氢离子的浓度越大,溶液的PH就越小,a,b,c三点的pH由小到大的顺序是b<a<c.(3)加入的水越多,电离的电解质就越多,电离程度就越大。所以 a、b、c三点中电离程度最大的是c,次点H+的物质的量最大;(4)A电解质电离过程是个吸热过程,加热,是温度升高,可以使平衡向电离的方向移动,导致c(CH3COO-)增大,A正确。B.加很稀的NaOH溶液,消耗了氢离子,减小了氢离子的浓度,是电离平衡向电离的方向移动,但由于是稀溶液,最终氢离子的浓度及c(CH3COO-)反而减小,B错误。C.加NaOH固体消耗氢离子,破坏了电离平衡,使电离平衡向电离的方向移动。由于醋酸跟离子没有消耗所以最后c(CH3COO-)增大,C正确。D.加水,平衡正向移动,电解质分子的浓度减小。由于电离平衡移动使c(CH3COO-)增大的趋势小于水对它的稀释作用,最后c(CH3COO-反而减小,D错误。E.加入锌粒消耗氢离子,破坏了电离平衡,促使它向电离的方向移动,最终 c(CH3COO-)增大,E正确。选A C E 。
考点:考查溶液的导电性与溶液稀释的关系及外界条件对电离平衡的影响的知识。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
He who would climb the ladder must begin at the bottom. 欲登梯者从底始.