|
|
|
下列叙述正确的是A.pH相等的盐酸和醋酸溶液中分别加入足量?【弱电解质电离平衡】
2016-12-25 23:12:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列叙述正确的是
A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中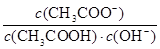 减来源:91考试网 91ExAm.org小 减来源:91考试网 91ExAm.org小
C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-)
|
选择题 下列叙述正确的是
A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中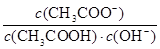 减小 减小
C .醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-)
|
本题答案:D
本题解析:
试题分析:A.相同pH,则氢离子浓度相同,产生氢气的起始速率相等,反应开始后醋酸中氢离子浓度大于盐酸中氢离子浓度,错误;B.醋酸是弱酸,存在电离平衡,稀释促进电离。由于
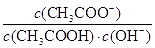
=
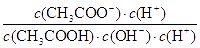
=
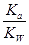
,因为温度不变,所以
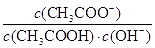
不变,错误;C.醋酸钠溶于水水解程度小是可逆反应,错误;D.根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-)=10-7mol/L,所以c(NH4+)=c(Cl-),正确。
考点:考查强弱电解质,弱电解质的。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
He that loseth his due gets not thanks. 失去应得的东西,别人不感谢。
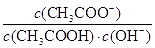 =
=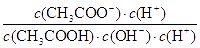 =
=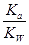 ,因为温度不变,所以
,因为温度不变,所以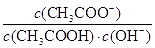 不变,错误;C.醋酸钠溶于水水解程度小是可逆反应,错误;D.根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-)=10-7mol/L,所以c(NH4+)=c(Cl-),正确。
不变,错误;C.醋酸钠溶于水水解程度小是可逆反应,错误;D.根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-)=10-7mol/L,所以c(NH4+)=c(Cl-),正确。