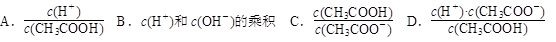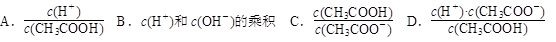|
|
|
(12分)在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线【弱电解质电离平衡】
2016-12-25 23:27:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 (12分)在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所 91eXAm.org示,请回答:
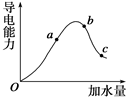
(1)O点为什么不导电 。
(2)a、b、c三点醋酸的电离度最大的是 ___(填“a”、“b”或“c”)。
(3)a、b、c三点的c(H+)由大到小的顺序是____________。
(4)在25℃时,已知c点溶液中pH="5," 则溶液中的c(OH-)= 。
(5)若使c点溶液中的c(CH3COO-)增大,不可以采取下列措施中的________ (填序号)。
A.加热
B.加水
C.加NaOH固体
D.加入锌粒
| (6)随溶液的稀释,下列各项中始终保持增大趋势的是________(填序号)。
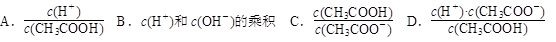
选择题 (12分)在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:

(1)O点为什么不导电 。
(2)a、b、c三点醋酸的电离度最大的是 ___(填“a”、“b”或“c”)。
(3)a、b、c三点的c(H+)由大到小的顺序是____________。
(4)在25℃时,已知c点溶液中pH="5," 则溶液中的c(OH-)= 。
(5)若使c点溶液中的c(CH3COO-)增大,不可以采取下列措施中的________ (填序号)。
A.加热
B.加水
C.加NaOH固体
D.加入锌粒
|
(6)随溶液的稀释,下列各项中始终保持增大趋势的是________(填序号)。
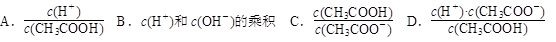
本题答案:(1)无自由移动的离子 (2分)(2)c(2分)(3)bac
本题解析:
试题分析:(1)冰醋酸是纯醋酸,没有水,不能电离,所以无自由移动的离子。(2)加水越多,醋酸电离程度越大,所以电离度最大的为c。(3)溶液的导电能力越大,溶液中的离子浓度越大,所以溶液中的氢离子浓度的大小顺序为:bac。(4)因为在25℃时水的离子积常数为10-14,所以氢氧根离子浓度=10-14/10-5=10-9mol/L。(5)A、加热电离平衡正向移动,醋酸根浓度增大;B、加水电离程度增大,但醋酸根离子浓度减小;C、加入氢氧化钠固体,电离平衡正向移动,溶液中的醋酸根离子浓度增大;D、加入锌,锌和氢离子反应,是电离平衡正向移动,醋酸根离子浓度增大 。所以选B。(6)A、加水稀释电离程度增大,所以氢离子与醋酸分子浓度比值变大;B、氢离子和氢氧根离子浓度的乘积是常数,不变;C、加水稀释,电离程度增大,所以比值减小;D、是醋酸的电离平衡常数,是定值,不变。所以选A。
考点:电离平衡移动。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【困难】
Poverty of speech is the outward evidence of poverty of mind. 语言贫乏说明头脑空虚。