|
|
|
已知草酸为二元弱酸:H2C2O4<img src="http://www.91exam.or【弱电解质电离平衡】
2016-12-25 23:38:35
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 已知草酸为二元弱酸:
H2C2O4 HC2O4-+H来源:91考试网 www.91eXam.org+ Ka1 HC2O4-+H来源:91考试网 www.91eXam.org+ Ka1
HC2O4- C2O42-+H+ Ka2 C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
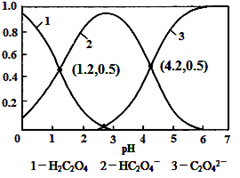
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
|
选择题 已知草酸为二元弱酸:
H2C2O4 HC2O4-+H+ Ka1 HC2O4-+H+ Ka1
HC2O4- C2O42-+H+ Ka2 C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
|
本题答案:C
本题解析:
试题分析:A、pH=1.2溶液中,电荷守恒:c(K+)
91exam .org+c(H+)=c(OH-)+c(HC2O4-),从图分析c(HC2O4-)=c(H2C2O4),所以有c(K+)+c(H+)=c(OH-)+c(H2C2O4),正确,不选A;B、根据电离平衡常数分析,K1=c(H+)c(HC2O4-)/c(H2C2O4)=10-1.2,K2=c(H+)c(C2O42-)/c(HC2O4-)=10-4.2,K1/K2=c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=10-1.2/10-4.2=1000,所以不选B;C、在pH=4.2时,c(C2O42-)=c(HC2O4-),溶液显酸性,说明草酸氢根的电离大于水解,所以当加入的草酸氢钾和草酸钾等物质的量加入时,电离大于水解后,二者的浓度不再相等,所以不可能配成pH=4.2的溶液,选C;D、从pH=1.2变到pH=4.2,溶液的酸性减弱,对水的电离抑制作用减弱,所以水的电离程度一直增大,不选D。
考点:溶液的酸碱性,盐类的水解,水的电离平衡
本题所属考点:【弱电解质电离平衡】
本题难易程度:【困难】
Bought wit is best, but may cost too much. 亲身的体验最好,只不过有时代价太高.