|
|
|
下列说法正确的是A.ΔH>0,ΔS>0的反应任何条件都是非自?【化学反应进行的方向】
2016-12-26 00:04:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列说法正确的是
A.ΔH>0,ΔS>0的反应任何条件都是非自发反应;
B.因N2(g)+3H2(g)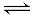 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
C.一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)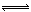 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态
D.H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(g) △H=-571.6 kJ·mol-1
|
选择题 下列说法正确的是
A.ΔH>0,ΔS>0的反应任何条件都是非自发反应;
B.因N2(g)+3H2(g)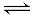 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
C.一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)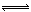 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态
D.H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(g) △H=-571.6 kJ·mol-1
|
本题答案:B
本题解析:
试题分析:△G=△H-T△S,对于ΔH>0、ΔS>0的反应当温度达到一定高时才能使△G<0,故ΔH>0,ΔS>0的反应并不能任何条件都是非自发反应,故A项错误;由反应N2(g)+3H2(g)
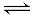
2NH3(g)△H=-d kJ/mol可知当有1 mol N2与3 mol H2完全反应时放出热量为d kJ,但在某容器中投入1 mol N2与3 mol H2,由于反应为可逆反应,故1 mol N2与3 mol H2不会完全反应,故放出热量小于d kJ,则B项正确;同一化学反应各物质的速率之比等于化学计量数之比,故一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)
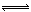
2SO3(g) △H<0,当v正(SO2)= 2v逆(SO3)时,该反应已达到平衡状态,故C项错误;燃烧热为1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,故H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ·mol-1,故D项错误;本题选B。
考点:化学反应能量变化。
本题所属考点:【化学反应进行的方向】
本题难易程度:【一般】
All fellows at football./ On the playing-field, all are on equality. 运动场上人人平等。
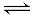 2NH3(g)△H=-d kJ/mol可知当有1 mol N2与3 mol H2完全反应时放出热量为d kJ,但在某容器中投入1 mol N2与3 mol H2,由于反应为可逆反应,故1 mol N2与3 mol H2不会完全反应,故放出热量小于d kJ,则B项正确;同一化学反应各物质的速率之比等于化学计量数之比,故一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)
2NH3(g)△H=-d kJ/mol可知当有1 mol N2与3 mol H2完全反应时放出热量为d kJ,但在某容器中投入1 mol N2与3 mol H2,由于反应为可逆反应,故1 mol N2与3 mol H2不会完全反应,故放出热量小于d kJ,则B项正确;同一化学反应各物质的速率之比等于化学计量数之比,故一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)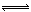 2SO3(g) △H<0,当v正(SO2)= 2v逆(SO3)时,该反应已达到平衡状态,故C项错误;燃烧热为1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,故H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ·mol-1,故D项错误;本题选B。
2SO3(g) △H<0,当v正(SO2)= 2v逆(SO3)时,该反应已达到平衡状态,故C项错误;燃烧热为1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,故H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ·mol-1,故D项错误;本题选B。