微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 某温度下,H2 (g) + CO2 (g)  H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数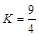 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
起始浓度(mol/L)
| 甲
| 乙
| 丙
| 丁
|
c(H2)
| 0.01
| 0.02
| 0.02
| 0.005
|
c(CO2)
| 0.01
| 0.01
| 0.来源:91考试网 91exam.org02
| 0.005
|
c(H2O)
| 0
| 0
| 0
| 0.005
|
c(CO)
| 0
| 0
| 0
| 0.005
|
下列判断有错的是
A.平衡时,乙中CO2的转化率>60%
B.平衡时,四容器中甲的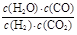 值最小
值最小
C.起始时丁向正反应方向进行
D.反应开始时,丙中反应速率最快
选择题 某温度下,H2 (g) + CO2 (g)  H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数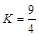 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
起始浓度(mol/L)
| 甲
| 乙
| 丙
| 丁
|
c(H2)
| 0.01
| 0.02
| 0.02
| 0.005
|
c(CO2)
| 0.01
| 0.01
| 0.02
| 0.005
|
c(H2O)
| 0
| 0
| 0
| 0.005
|
c(CO)
| 0
| 0
| 0
| 0.005
|
下列判断有错的是
A.平衡时,乙中CO2的转化率>60%
B.平衡时,四容器中甲的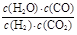 值最小
值最小
C.起始时丁向正反应方向进行
D.反应开始时,丙中反应速率最快
本题答案:B
本题解析:根据平衡常数可知,甲中平衡时生成CO和水的物质的量浓度都是x,则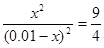 ,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中
,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中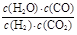 =
=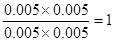 <
<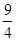 ,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
本题所属考点:【化学平衡】
本题难易程度:【一般】
Take time by the forelock. 要把握时机.