微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 900
| a
| b
| c
| d
| t
|
①实验1中以v (CO2) 表示的反应速率为 (取小数点后二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 来源:91考试网 91ExAm.org 。
(3) 某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
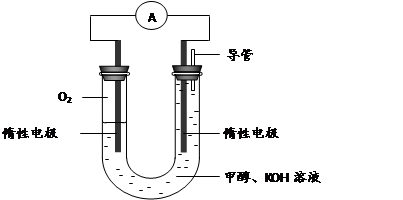
①该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
⑷CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
填空题 (14分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)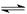 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 900
| a
| b
| c
| d
| t
|
①实验1中以v www.91eXam.org(CO2) 表示的反应速率为 (取小数点后二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(3) 某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。

①该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
⑷CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
本题答案:(1)5 C+ 4 KMnO4+ 6 H2SO4
本题解析:
试题分析:(1)根据氧化还原反应氧化剂、还原剂得失电子数目相等配平,反应中C元素化合价0→+4,Mn元素化合价+7→+2,反应得失电子相等,则有:5C~4KMnO4,根据质量守恒可确定H2SO4的计量数为6,则配平后的计量数分别是:5、4、6、5、4、2、6;
(2)①v(CO2)=v(CO)=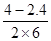 =0.13moL/(L?min);
=0.13moL/(L?min);
②实验1,达平衡时:c(H2)=0.8mol/L,c(CO2)=0.8mol/L,c(H2O)=0.2mol/L,c(CO)=1.2mol/L,则k=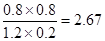
实验2,达平衡时:c(H2)=0.2mol/L,c(CO2)=0.2mol/L,c(H2O)=0.3mol/L,c(CO)=0.8mol/L,则k=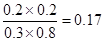
则升高温度平衡常数减小,平衡向逆反应分析移动,说明正反应放热;
(3)碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
则总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O;
(4)由Ksp(CaCO3)=c(CO32-)×c(Ca2+),
可知:c(CaCl2)=c(Ca2+)=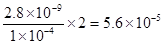 mol/L,
mol/L,
考点:化学平衡常数的含义;氧化还原反应方程式的配平;热化学方程式;原电池和电解池的工作原理;难溶电解质的溶解平衡及沉淀转化的本质。
点评:本题考查较为综合,涉及化学平衡、反应热、电化学以及难溶电解质的溶解平衡等问题,题目难度较大,学习中注意相关解答方法的积累。
本题所属考点:【化学平衡】
本题难易程度:【一般】
A barly-corn is better than a diamond to a cock. 对于公鸡来说,麦粒胜过钻石.