微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 在一定温度下,在10L密闭容器中加入5molSO2和一定量的氧气,在一定条件下发生反应: 2SO2(g)+O2(g) 2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
(1)氧气的起始浓度为 。
(2)平衡时剩余SO2 mol;
(3)该条件下SO2的最大转化率为 ;
(4)平衡时体系中SO3的百分含量(体积分数)为 ;
(5)平衡体系中SO2、O2和SO3的物质的量之比为 。
填空题 在一定温度下,在10L密闭容器中加入5molSO2和一定量的氧气,在一定条件下发生反应: 2SO2(g)+O2(g) 2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
2SO3(g)。达平衡时容器中SO3的物质的量浓度为0.4mol/L,还剩余氧气3.0mol。
(1)氧气的起始浓度为 。
(2)平衡时剩余SO2 mol;
(3)该条件下SO2的最大转化率为 ;
(4)平衡时体系中SO3的百分含量(体积分数)为 ;
(5)平衡体系中SO2、O2和SO3的物质的量之比为 。
本题答案:(5分)(1)0.5mol/L;(2)1; (3)80%;(
本题解析:
试题分析: 2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.5 x 0
转化浓度(mol/L) 0.4 0.2 0.4
平衡浓度(mol/L) 0.1 0.3 0.4
所以氧气的起始浓度为0.2mol/L+0.3mol/L=0.5mol/L
平衡时剩余SO2的物质的量是0.1mol/L×10L=1mol
该条件下SO2的最大转化率为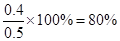
平衡时体系中SO3的百分含量(体积分数)为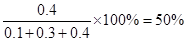
平衡体系中SO2、O2和SO3的物质的量之比为0.1:0.3:0.4=1:3:4
考点:考查可逆反应的有关计算
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题所属考点:【化学平衡】
本题难易程度:【一般】
No herb will cure love. 相思病无药医.