微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示:

(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 ; 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
t/s
| 0
| 50
| 100
|
c(N2O5)/mol·L—1
| 5.0
| 3.5
| 2.4
|
则50s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
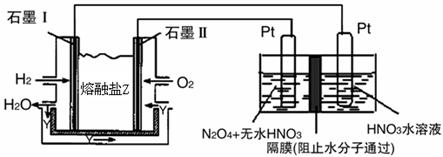
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
填空题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示:

(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
t/s
| 0
| 50
| 100
|
c(N2O5)/mol·L—1
| 5.0
| 3.5
| 2.4
|
则50s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
本题答案:(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(
本题解析:
试题分析:(1)氨气和氧气反应生成一氧化氮和水,由所给热化学方程式
N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol ①
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol ②
2NH3(g) △H=-92.4kJ/mol ②
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol ③
根据盖斯定律得(①-②)×2+③×3可得所求,答案是4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H =-905.0kJ/mol
(2)①T2的氨气含量高于T1的氨气含量,温度低对合成氨有利,所以T2低于T1
②a、b、c三点中c点的氢气的物质的量最大,根据化学平衡中增大一种反应物的量,会增大另一种反应物的转化率,所以c点的氮气的转化率最高;
③氢气的起始浓度为3mol/L,氮气的起始浓度为1mol/L,氢气的转化率为60%,所以平衡时:c(H2)= 1.2mol/L,c(N2)=0.4mol/L,c(NH3)=1.2 mol/L,所以化学平衡常数K= c(NH3)2/c(N2)·c(H2)3=25/12
(3) ①50s内N2O5浓度减少1.5mol/L,则NO2的浓度增加3 mol/L,所以NO2的平均生成速率为3 mol/L/50s=0.06mol?L-1?s-1
②左池为氢氧燃料电池装置,石墨I电极上发生氧化反应,电极反应式为H2 + CO32---2e- = CO2 + H2O
右池为电解池装置,N2O5在阳极生成,石墨Ⅱ为阳极,发生氧化反应,电极反应式为:阳极:N2O4 + 2HNO3 -2e— =2N2O5 +2H+
考点:考查盖斯定律的应用,化学平衡中反应速率的计算、转化率的比较,原电池、电解池的综合应用
本题所属考点:【化学平衡】
本题难易程度:【困难】
Diamond cuts diamond. 强中自有强中手.