|
|
|
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生?【化学平衡】
2016-12-26 15:29:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为

其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—)
| | C.溶液的颜色不变 | D.溶液的pH值不变
| (3)写出第②步中Cr2O72-转变为Cr3+的离子方程式: 。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
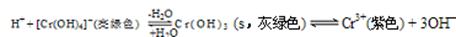
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为 ,溶液中离子浓度由大到小的顺序为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
填空题 工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为

其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—)
|
| C.溶液的颜色不变 | D.溶液的pH值不变
|
(3)写出第②步中Cr2O72-转变为Cr3+的离子方程式:
。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,
来源:91考试网 91exam.org沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
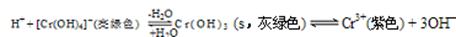
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为
,溶液中离子浓度由大到小的顺序为
。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以
形式存在(填写离子符号)。
本题答案:(1)橙
(2)C D
(3)Cr2O72-+6
本题解析:
试题分析:
(1)第①步存在平衡:2CrO42—(黄色)+2H+

Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
(2)当反应达到平衡状态时,任何微粒的浓度都保持不变。对每种微粒来说消耗的浓度与产生的浓度相等,即V(正)=V(逆)。溶液的颜色不变,溶液的pH不变,v正(Cr2O72—) ="1/2v" 逆(CrO42—).但不同的微粒的浓度可能相等,也可能不等。因此能说明第①步反应达平衡状态的是C、D。
(3)根据电荷守恒、原子守恒及电子守恒定律可知:第②步中Cr2O72-转变为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
(4)现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液时,c(Cr3+)="0." 1mol/L,n(Cr3+)="0.005mol" ,c(OH-)=0.3mol/L,溶液的pH>4.6所以会发生反应Cr3++3OH-=Cr(OH)3↓, 反应消耗OH-的物质的量为0.015mol,剩余OH-的物质的量为0.3mol/L×0.1L- 0.015mol=0.015mol,c(OH-)="0.015mol" ÷0.1L=0.15mol/L.大于pH=13时的c(OH-)。所以会再发生 Cr(OH)3+ H2O=H++ [Cr(OH)4]2-。因此溶液呈亮绿色。即溶液的颜色由紫色变为亮绿色。c(SO42-)=0.075mol/L,n(Na+)="0.3mol/L," c(OH--)=(0.03mol-4×0.005mol)÷0.1L="0.1mol/L" , c(H+)=Kw÷c(OH--)=10-14÷0.1=10-13mol/L, c([Cr(OH)4]-)=" 0.05mol/L" 。所以溶液中离子浓度由大到小的顺序为c(Na+)>c(OH--)>c(SO42--)>c([Cr(OH)4]-)>c(H+)。
(5)在Na[Cr(OH)4] 溶液中加入H2SO4酸化由关系式
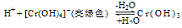
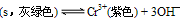
可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+

Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
考点:考查化学平衡状态的判断、平衡移动、离子浓度的大小比较、离子方程式的书写的知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Even reckoning makes long friends. 帐目清楚,友情久长.
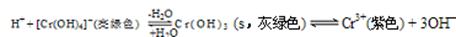
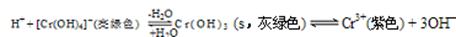
 Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。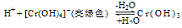
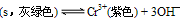 可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+
可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。