|
|
|
(15分)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新【化学平衡】
2016-12-26 15:32:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g)= NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s)= CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l)= H2O(g) △H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式 。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0 CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L—1,H2:0.8mol·L—1,CH4:0.8mol·L—1,H2O:1.6mol·L—1,起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g) ,300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
A.容器I、II中正反应速率相同
B.容器I、II中CH4的物质的量分数相同
C.容器I中CO2的物质的量比容器II中的多
D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1
| (3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
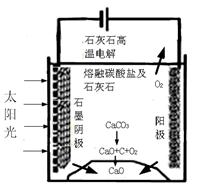
①上述生产过程的能量转化方式是 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 & #160; 。
填空题 (15分)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g)= NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s)= CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l)= H2O(g) △H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式 。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0 CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L—1,H2:0.8mol·L—1来源:www.91exam.org,CH4:0.8mol·L—1,H2O:1.6mol·L—1,起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g) ,300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
A.容器I、II中正反应速率相同
B.容器I、II中CH4的物质的量分数相同
C.容器I中CO2的物质的量比容器II中的多
D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1
|
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是
。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为
,阴极的电极反应式为
。
本题答案:(1)2NH3(g)+ CO2(g)=CO(NH2)2(s)
本题解析:
试题分析:(1)由①+②-③可得:2NH3(g)+ CO2(g)=CO(NH2)2(s)+H2O(l) △H =—130.98 kJ·mol-1 (3分)
(2)①假设起始的二氧化碳的物质的量为xmol,氢气的物质的量为ymol:
CO2(g) + 4H2(g)

CH4(g) + 2H2O(g) ΔH<0
起始物质的量: xmol ymol 0 0
转化物质的量: 1.6mol 6.4mol 1.6mol 3.2mol
平衡物质的量: 0.4mol 1.6mol 1.6mol 3.2mol
那么:x=0.4mol+1.6mol=2.0mol y=6.4mol+1.6mol=8.0mol
CO2的平衡转化率为:

②A、容器I、II中的起始反应物不一样,因此正反应速率不一定相等,错误;B、如果不是一个绝热容器,那么在两个容器中按题中的投料是等效平衡,也就是说两个容器中甲烷的含量应该相等,但这是一个绝热的容器,如果是二氧化碳和氢气生成甲烷和水,正反应是放热反应,放出的热量使容器温度升高,升高温度会使得平衡逆向移动,使得甲烷的含量比前述的等效平衡时的要低,而投入甲烷和水,生成的是二氧化碳和氢气,要吸热,使得体系的温度降低,而温度的降低使得平衡正向移动,使得甲烷的含量比前述的等效平衡时的要高,因此容器I、II中CH4的物质的量分数不相同,错误;C、容器I中是在前述等效平衡的基础上逆向移动,容器II中是在前有识述等效平衡的基础上正向移动,所以容器I中CO2的物质的量比容器II中的多,正确;D、如果按照等效平衡来考虑的话,容器I中CO2的转化率与容器II中CH4的转化率之和等于1,但这是在绝热容器中,是在等效平衡的基础上又分别进行了移动,因此,容器I中CO2的转化率与容器II中CH4的转化率之和小于1,正确。
(3)①从图中可知装置是将太阳能和电能转化为化学能(2分)
②阳极是失去电子的反应:2CO32--4e-=2CO2↑+O2↑;阴极是得到电子的反应,得电子的物质只能是二氧化碳:3CO2+4e-=C+2CO32-。
考点:考查反应热、化学平衡以及电化学的有关知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
To know everything is to know nothing. 样样都通,件件稀松.


 CH4(g) + 2H2O(g) ΔH<0
CH4(g) + 2H2O(g) ΔH<0