微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)
(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
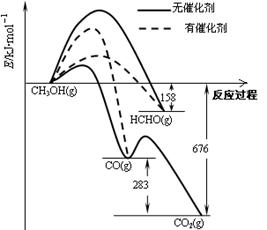
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2” 或“HCHO”)。2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性。用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
(2)已知:CO(g)+ 2H2(g) CH3OH(g)△H =" -a" kJ?mol-1。
CH3OH(g)△H =" -a" kJ?mol-1。
①经测定不同温度下该反应的平衡常数如下:
温度(℃)
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1,则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min)
| 5
| 10
| 15
| 20
| 25
| 30
|
压强比(P后/P前)
| 0.98
| 0.90
| 0.80
| 0.70
| 0.70
| 0.70
|
则0~15 min,用H2表示的平均反应速率为 ,达到平衡时CO的转化率为 。
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染。吸收液吸收SO2的过程中,pH随n(SO3²-)∶n(HSO3-)变化关系如下表:
n(SO3²-)∶n(HSO3-)
| 91∶9
| 1∶1
| 1∶91
|
pH
| 8.2
| 7.2
| 6.2
|
根据上表判断NaHSO3溶液显 &来源:91考试网 www.91eXam.org#160; 性。
② 在NaHSO3溶液中离子浓度关系正确的是 (填字母)。
a. c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
b. c(Na+)= 2c(SO32-)+ c(HSO3-)
c. c(H2SO3)+ c(H+)= c(SO32-)+ (OH-)
d. c( Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
填空题 (15分)
(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。

①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2” 或“HCHO”)。2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性。用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
(2)已知:CO(g)+ 2H2(g) CH3OH(g)△H =" -a" kJ?mol-1。
CH3OH(g)△H =" -a" kJ?mol-1。
①经测定不同温度下该反应的平衡常数如下:
温度(℃)
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1,则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min)
| 5
| 10
| 15
| 20
| 25
| 30
|
压强比(P后/P前)
| 0 .98
| 0.90
| 0.80
| 0.70
| 0.70
| 0.70
|
则0~15 min,用H2表示的平均反应速率为 ,达到平衡时CO的转化率为 。
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染。吸收液吸收SO2的过程中,pH随n(SO3²-)∶n(HSO3-)变化关系如下表:
n(SO3²-)∶n(HSO3-)
| 91∶9
| 1∶1
| 1∶91
|
pH
| 8.2
| 7.2
| 6.2
|
根据上表判断NaHSO3溶液显 性。
② 在NaHSO3溶液中离子浓度关系正确的是 (填字母)。
a. c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
b. c(Na+)= 2c(SO32-)+ c(HSO3-)
c. c(H2SO3)+ c(H+)= c(SO32-)+ (OH-)
d. c( Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
本题答案:28.(除(3)中①外,每空2分,共15分)
(1)①
本题解析:
试题分析:(1)①使用催化剂能够降低反应的活化能,活化能越小,反应越容易发生,所以在有催化剂作用下,CH3OH与O2反应主要生成HCHO, 2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=—2(676-158-283)= —470KJ/moL ②氯化银与氨水可以发生络合反应,故离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl- ;(2)①根据浓度熵(Q)和化学平衡常数(K)的大小来确定反应方向,若Q>K,反应逆向进行,反之,反应正向进行,通过计算反应正向进行即v正〉v逆②等温、等体积的可逆反应,气体的压强与其物质的量成正比,从而能够计算出氢气的物质的量,再根据公式:Δn/VΔt计算反应速率,再根据CO反应的物质的量,计算转化率。(3)①由表格中的数据可知当n(SO3²-)∶n(HSO3-)=1:91时PH=6.2说明HSO3-的电离能力大于其水解能力,所以NaHSO3溶液显酸性②因HSO3-的电离能力大于其水解能力,所以离子浓度排序为:c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),该溶液中还存在着电荷守恒和物料守恒,因此在NaHSO3溶液中离子浓度关系正确的是ac
考点:考察离子方程式的书写;焓变的计算;离子浓度大小的比较,化学平衡的影响因素及计算等知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Time flies. 光阴似箭.