微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (4分)工业上常用天然气作为制备甲醇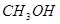 的原料。已知:
的原料。已知:
①
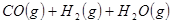
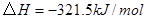
②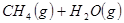
③
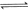
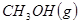
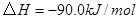
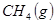 与
与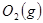 反应生成
反应生成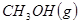 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入 与
与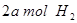 ,在不同压强下合成甲醇。
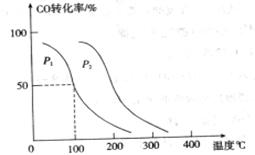
,在不同压强下合成甲醇。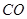 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示:
①压强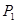
 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在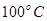 、
、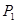 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含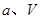 的代数式表示)。
的代数式表示)。
填空题 (4分)工业上常用天然气作为制备甲醇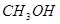 的原料。已知:
的原料。已知:
①
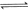
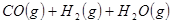
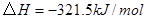
②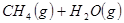
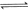
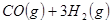
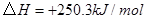
③
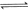
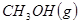
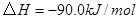
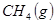 与
与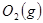 反应生成
反应生成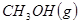 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入 与
与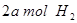 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。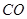 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示:

①压强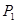
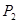 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在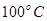 、
、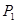 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含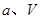 的代数式表示)。
的代数式表示)。
本题答案:(1)2CH4(g)+O2(g)=2CH3OH (g) ΔH
本题解析:
试题分析:(1)①+②+③×2整理可得2CH4(g)+O 2(g)=2CH3OH (g) ΔH=-251.2KJ/mol。(2)① 作一条等温线,通过P1、P2,可见在相同的温度下,压强是P2时CO 的平衡转化率高,由于该反应的正反应是气体体积减小的反应,根据压强对平衡移动的影响,增大压强,平衡正向移动,物质的转化率提高,所以压强P1< P2. ②在100℃、P1压强时,由于CO的转化率是50%,则平衡时CO的物质的量浓度是0.5a/Vmol/L; H2的物质的量浓度是a/Vmol/L; CH3OH的物质的量浓度是0.5a/Vmol/L;所以平衡常数为0.5a/V÷[0.5a/V×(a/V)2]= V2/a2。
考点:考查盖斯定律的应用、热化学方程式的书写、压强对化学平衡移动的影响、化学平衡常数的计算。
本题所属考点:【化学平衡】
本题难易程度:【困难】
When a dog bites a man that is not news, but when a man bites a dog that is news. 狗咬人不是新闻,人咬狗才是新闻。