微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物。已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1;18.0 g水蒸气液化时的能量变化为44.0 kJ。
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式 。
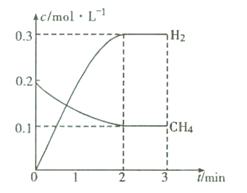
(2)在一定条件下,向体积固定为2 L的密闭容器中充人0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示。3 min时改变条件,反应进行到4 min时,体系中各物质的物质的量如下表所示:
t/min
| n(CH4)/mol
| n(H2O)/mol
| n(CO)/mol
| n(H2)/mo1
|
4
| 0.18
| 0.38
| 0.22
| 0.66
|
则3~4min之间,平衡向 (填“正”或“逆”)反应方向移动,3min时改变的条件是 。
(3)已知温度、压强和碳水比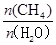 对该反应的影响如图所示。
对该反应的影响如图所示。
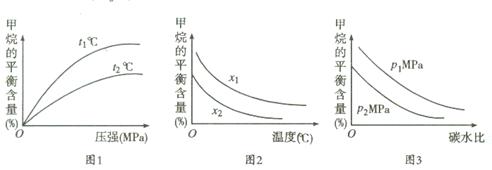
①图1中,两条曲线所示温度的关系:t1 t2(填“>”、“<”或“=”,下同)
②图2中,两条曲线所示碳水比的关系:x1 x2
③图3中,两条曲线所示压强的关系:p1 p2
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
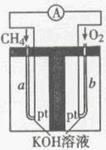
①放电时,正极的电极反应式为  
②假设装置中盛装100.0 mL 3.0mol·L-1KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为 。
填空题 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物。已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1;18. 0 g水蒸气液化时的能量变化为44.0 kJ。

(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式 。
(2)在一定条件下,向体积固定为2 L的密闭容器中充人0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示。3 min时改变条件,反应进行到4 min时,体系中各物质的物质的量如下表所示:
t/min
| n(CH4)/mol
| n(H2O)/mol
| n(CO)/mol
| n(H2)/mo1
|
4
| 0.18
| 0.38
| 0.22
| 0.66
|
则3~4min之间,平衡向 (填“正”或“逆”)反应方向移动,3min时改变的条件是 。
(3)已知温度、压强和碳水比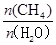 对该反应的影响如图所示。
对该反应的影响如图所示。

①图1中,两条曲线所示温度的关系:t1 t2(填“>”、“<”或“=”,下同)
②图2中,两条曲线所示碳水比的关系:x1 x2
③图3中,两条曲线所示压强的关系:p1 p2
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。

①放电时,正极的电极反应式为
②假设装置中盛装100.0 mL 3.0mol·L-1KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为 。
本题答案:(1)CH4(g)+H2O(g)=CO(g)+3H2(g)&
本题解析:
试题分析:(1)根据题意可得燃烧热的化学方程式是①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ?H1=-890.3 kJ/mol;②H2(g)+1/2O2(g)= H2O(l) ?H2=-285.8 kJ/mol;③CO(g)+1/2O2(g)=CO2(g) ?H3=-283.0 kJ/mol;④H2O(g)= H2O(l) ?H4=-44.0 kJ/mol;①-③-②×3+④整理可得甲烷与水蒸气在高温下反应制合成气的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g) ?H=+206.1KJ/mol;(2)根据图示可知:在反应达到平衡时各种物质的浓度分别是:c(CH4)=0.1mol/L;c(H2O)="0.2" mol/L ;c(CO)=" 0.1mol/L" ;c(H2)= 0.3mol/L.此时化学平衡常数K=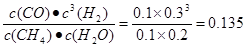 ,在第4min时,各种物质的浓度分别是c(CH4)=0.09mol/L;c(H2O)="0.19" mol/L ;c(CO)=" 0.11mol/L" ;c(H2)= 0.33mol/L.此时各种生成物浓度幂指数的乘积与各种反应物浓度幂指数的乘积的比是Q=
,在第4min时,各种物质的浓度分别是c(CH4)=0.09mol/L;c(H2O)="0.19" mol/L ;c(CO)=" 0.11mol/L" ;c(H2)= 0.33mol/L.此时各种生成物浓度幂指数的乘积与各种反应物浓度幂指数的乘积的比是Q= 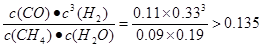 。所以3~4min之间,平衡向正反应方向移动;由于该反应的正反应是气体体积增大的吸热反应,所以在3min时改变的条件是升高温度;(3)①图1中,由于在压强相同时,在温度为t1时甲烷的含量高于温度为t2时甲烷的含量,根据平衡移动原理降低温度平衡向放热反应方向移动,可知:两条曲线所示温度的关系:t1< t2;②根据图2中,在相同温度时,碳水比
。所以3~4min之间,平衡向正反应方向移动;由于该反应的正反应是气体体积增大的吸热反应,所以在3min时改变的条件是升高温度;(3)①图1中,由于在压强相同时,在温度为t1时甲烷的含量高于温度为t2时甲烷的含量,根据平衡移动原理降低温度平衡向放热反应方向移动,可知:两条曲线所示温度的关系:t1< t2;②根据图2中,在相同温度时,碳水比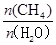 为x1时甲烷的平衡含量高于x2时甲烷的平衡含量,根据物质浓度对平衡的影响,增大反应物的浓度,可以使其它反应物的转化率提高,而其本身的转化率反而降低可知两条曲线所示碳水比的关系:x1>x2;③图3中,在相同的碳水比时,增大压强,平衡向逆向移动,甲烷的平衡含量增大,由于在压强为p1的含量高于压强为p2时的含量,所以两条曲线所示压强的关系:p1>p2;(4)以天然气为原料的燃料电池①在放电时,正极b的电极反应式为O2+4e-+2H2O=4OH-,②n(O2)=" 8.960" L÷22.4L/mol=0.4mol,则反应的甲烷的物质的量为0.2mol,产生的CO2的物质的量是0.2mol.n(KOH)= 0.1L×3.0mol/L=0.3mol,所以在溶液中K2CO3、KHCO3的物质的量都是0.1mol.由于K2CO3水解程度大于KHCO3,所以在溶液中c(HCO3-)>c(CO32-)。二者水解是溶液显碱性,所以c(OH-)>c(H+)。但是盐的水解程度是微弱的,主要还是以离子的形式存在,所以c(CO32-)>c(OH-)。根据物料守恒可知c(K+)>c(HCO3-)。所以离子浓度的大小关系是:c(K+)>c(HCO3-)> c(CO32-)>c(OH-)> c(H+)。
为x1时甲烷的平衡含量高于x2时甲烷的平衡含量,根据物质浓度对平衡的影响,增大反应物的浓度,可以使其它反应物的转化率提高,而其本身的转化率反而降低可知两条曲线所示碳水比的关系:x1>x2;③图3中,在相同的碳水比时,增大压强,平衡向逆向移动,甲烷的平衡含量增大,由于在压强为p1的含量高于压强为p2时的含量,所以两条曲线所示压强的关系:p1>p2;(4)以天然气为原料的燃料电池①在放电时,正极b的电极反应式为O2+4e-+2H2O=4OH-,②n(O2)=" 8.960" L÷22.4L/mol=0.4mol,则反应的甲烷的物质的量为0.2mol,产生的CO2的物质的量是0.2mol.n(KOH)= 0.1L×3.0mol/L=0.3mol,所以在溶液中K2CO3、KHCO3的物质的量都是0.1mol.由于K2CO3水解程度大于KHCO3,所以在溶液中c(HCO3-)>c(CO32-)。二者水解是溶液显碱性,所以c(OH-)>c(H+)。但是盐的水解程度是微弱的,主要还是以离子的形式存在,所以c(CO32-)>c(OH-)。根据物料守恒可知c(K+)>c(HCO3-)。所以离子浓度的大小关系是:c(K+)>c(HCO3-)> c(CO32-)>c(OH-)> c(H+)。
考点:考查盖斯定律的应用、热化学方程式的书写、化学平衡移动、外界条件的比较、离子浓度大小比较。
本题所属考点:【化学平衡】
本题难易程度:【困难】
He that believes all, misseth; he that believes nothing,hits not. 全信必有所失,全不信一无所得。