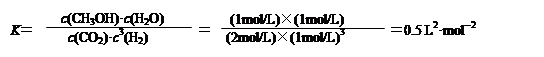|
|
|
工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下【化学平衡】
2016-12-26 15:57:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题:
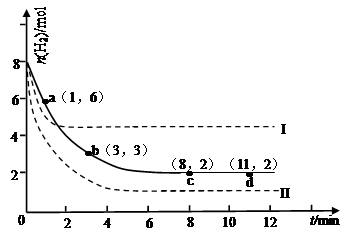
(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
A.0~1min
B.1~3min
C.3~8min
D.8~11min
| (3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
填空题 工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题:

(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
A.0~1min
B.1~3min
C.3~8min
D.8~11min
|
(3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是
,曲线II对应的实验条件改变是
。
本题答案:CO2(g)+3H2(g) = CH3OH(g)+H2O(g
本题解析:
试题分析:已知4.4g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95kJ的能量,则1mol二氧化碳全部反应放热49.5KJ;结合热化学方程式书写方法写出热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
(1)根据图象可知,a到b过程中氢气的物质的量减小,说明反应向着正向移动,正反应速率大于逆反应速率,
故答案为:大于;
(2)由图1可知,0~1min内氢气的变化量为8mol-6mol=2mol; B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol; C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;D.8~11min达平衡状态,氢气的物质的量不再变化.故1~3min速率增大,8~11min速率最小,
故答案为:A;D;
(3)由图象可知,实线表示的曲线,在8分钟达到平衡状态,此时氢气的物质的量为2mol,氢气的浓度为:2/2=1mol/L氢气的浓度变化为:8/2减去1等于3mol反应前二氧化碳的浓度为:6/2=3mol/L利用化学平衡的三段式可得,
CO2(g)+3H2(g)

CH3OH(g)+H2O(g)
起始物质的量浓度(mol /L) 3 4 0 0
转化物质的量浓度(mol / L) 1 3 1 1
平衡物质的量浓度(mol /L) 2 1 1 1 (1分)
H2的转化率=
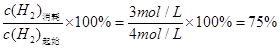
或0.75
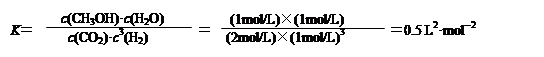
(4)对于可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强.
考点:本题考查化学平衡图象、反应速率大小判断、外界条件对平衡的影响等
本题所属考点:【化学平衡】
本题难易程度:【一般】
Dry bread at home is better than roast meat abroad. 在外吃烤肉不如在家啃面包.
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)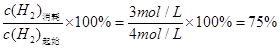 或0.75
或0.75