微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 (14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质
| CH4
| CO2
| CO
| H2
|
体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) www.91eXam.org △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ;
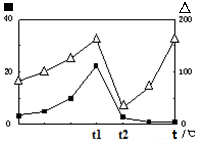 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
简答题 (14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质
| CH4
| CO2
| CO
| H2
|
体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ;
 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧 化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
本题答案:(共14分,每空2分)(1)①64 &
本题解析:
试题分析:(1)① CO2(g)+CH4(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始(mol) 6 6 0 0
反应(mol) X X 2X 2X
平衡(mol) 6-X 6-X 2X 2X
由CH4的体积分数为0.1,则 =0.1,解得X=4,所以K=
=0.1,解得X=4,所以K= =64;
=64;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g) 2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1;
2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1;
③温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
④正反应是体积减小的可逆反应,降低压强、增大CO2的浓度,平衡正向移动,反应物转化率增大;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则此时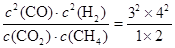 =72>64,所以上述平衡向逆反应方向移动。
=72>64,所以上述平衡向逆反应方向移动。
(2)①CO2的结构式为O=C=O,发生加聚反应得到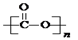 ;
;
②原电池中负极失去电子,正极得到电子,因此CO2在正极发生还原反应转化为甲烷,电极反应为:CO2+8e-+6H2O=CH4+8OH-。
考点:考查化学反应常数、化学平衡以及原电池原理的运用
本题所属考点:【化学平衡】
本题难易程度:【一般】
Choose neither a woman nor linen by candlelight. 不要在烛光下选妻子或内衣.