|
|
|
(12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,【化学平衡】
2016-12-26 16:04:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
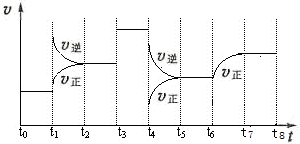
填空题 (12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻 ,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。 2NH3(g) △H=-92.0kJ /mol。t0时刻 ,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
| (3)t1时刻,改变的外界条件是__________,平衡常数K(t5~t6) ______ K(t7~t8)(填“>、<或=”,下同)。
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
填空题 (12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。

试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
|
(3)t1时刻,改变的外界条件是__________,平衡常数K(t5~t6) ______ K(t7~t8)(填“>、<或=”,下同)。
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
本题答案:(12 分,每空2分)
(1) 50 %; 16(mo
本题解析:
试题分析:(1)根据N2(g)+3H2(g)

2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,
来源:91考试网 91ExaM.org所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
(2)A、该反应前后气体的系数不相等,所以体系总压强不再改变,反应达到平衡;B、反应体系中各气体均为无色,所以混合气体颜色不再改变不能说明建立平衡;C、H2的质量百分含量不再改变,说明反应已达到平衡;D、c(N2)与c(NH3)的比值不再改变,说明c(N2)与c(NH3)不变,反应已达到平衡。
(3)t1时刻,正、逆反应速率都增大,逆反应速率更大,平衡向逆反应方向移动,该反应为放热反应,所以改变的条件是升温;t6正反应速率在原来的基础上逐渐增大,则改变的条件不是温度,所以平衡常数不变,所以K(t5~t6) = K(t7~t8)。
(4)向容器中加入2molN2和2molNH3,c(N2)=(1mol+2mol)÷2L=1.5mol?L?1,c(NH3)=(2mol+2mol)÷2L=2mol?L?1,则浓度积=(2mol?L?1)2÷[1.5mol?L?1×(0.5mol?L?1)3]=21.3(mol?L?1)-2 > K,平衡向正反应方向移动,所以v正 > v逆。
考点:本题考查转化率的计算、化学平衡常数的计算及计算、化学平衡状态的判断、化学平衡移动。
本题所属考点:【化学平衡】
本题难易程度:【困难】
The chains of habit are too weak to be felt until they are too strong to be broken. 习惯之链很弱,往往感觉不到,一旦感觉到了,已经牢固得绷不断了。
 2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,来源:91考试网 91ExaM.org所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,来源:91考试网 91ExaM.org所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。