微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
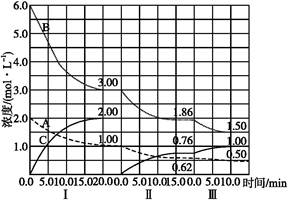
填空题 反应:aA(g)+bB(g)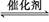 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)反应的化学方程式中,a∶b∶c为 ;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 ;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲 91EXAM.org线上必须标出A、B、C)。
填空题 反应:aA(g)+bB(g)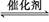 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为 ;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 ;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
本题答案: (1)1∶3∶2 (2)vⅠ(A)&
本题解析:
试题分析: (1)Ⅰ阶段,20 min 内,Δc(A)=2.0 mol·L-1-1.00 mol·L-1=1.00 mol·L-1,Δc(B)=6.0 mol·L-1-3.00 mol·L-1=3.00 mol·L-1,Δc(C)=2.00 mol·L-1,则a∶b∶c=Δc(A)∶Δc(B)∶Δc(C)=1∶3∶2。
(2)vⅠ(A)==0.05 mol·L-1·min-1,
vⅡ(A)=≈0.025 mol·L-1·min-1,
vⅢ(A)==0.012 mol·L-1·min-1。则vⅠ(A)>vⅡ(A)>vⅢ(A)。
(3)αⅠ(B)=×100%=50%,αⅡ(B)=×100%=38%,αⅢ(B)=×100%=19%。故αⅢ(B)最小。
(4)由图示可知,由第一次平衡到第二次平衡,A、B的浓度减小,说明平衡正向移动。由物质C的浓度变化可知,导致平衡正向移动的措施是从反应体系中移出了产物C。
(5)由图示可知,Ⅱ→Ⅲ,平衡正向移动,由于正反应是放热反应,故Ⅱ→Ⅲ是降温过程,即T2>T3。
(6)第三次平衡后,将容器的体积扩大一倍,则各物质的浓度减半,由于容器的体积扩大,压强减小,平衡会向逆反应方向(气体体积增大的方向)移动,故平衡后,0.25 mol·L-1<c(A)<0.50 mol·L-1,0.75 mol·L-1<c(B)<1.50 mol·L-1,0<c(C)<0.50 mol·L-1。注意各物质浓度的相对变化应符合化学计量数的比例。
考点:化学平衡移动、平衡计算
本题所属考点:【化学平衡】
本题难易程度:【一般】
Without hard work there won't be any scientific creations. 没有艰苦劳动,就没有科学创造.