|
(15分)工业上研究燃料脱硫的过程中,涉及如下反应: CaSO4【化学平衡】
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度): CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):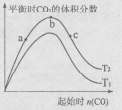 ①比较在a、b、c三点所处的平衡状态中,反应物 SO2的转化率最高的是 ____ 。 ②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的 理由是____ 。 填空题 (15分)工业上研究燃料脱硫的过程中,涉及如下反应: |
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
 CaS(s)+3CO2(g)的△H=-394kJ/mol; K1=
CaS(s)+3CO2(g)的△H=-394kJ/mol; K1=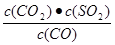 ; K2=
; K2=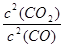 ;K=
;K=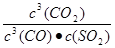 ;所以K=
;所以K=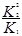 。(2)在反应I中,前100 s 内v(CO)=(2-1.1)mol/L÷100s=0.009mol/(L·s),v(SO2)="=" v(CO)=0.009mol/(L·s);平衡时CO的转化率为[(2-0.8)÷2]×100%=60%;(3)若只研究反应II,在不同条件下其反应能量变化如图所示,由于降低了反应的活化能,反应热没有变化,所以图中曲线a到曲线b的措施是加入了催化剂;A.由于反应前后气体的质量发生了变化,而气体的物质的量不变,所以若体系中气体的平均摩尔质量不再改变,则气体的质量不再发生变化,反应达到平衡状态,正确;B.因为在方程式是两种气体的方程式的系数相同,所以在任何时刻都存在v(CO)=v(CO2),因此不能作为判断反应达到平衡的标志,错误;C.反应物CO达到平衡时其的转化率达到了最大限度,正确;D.由于容器的容积不变,反应前后气体的体积相等,所以在任何时刻都存在体系内气体压强不再发生变化,故不能作为判断反应达到平衡状态的标志,错误;(4)①根据图像可知a、b、c三点同一温度下不同的n(CO)开始投入量的所处的平衡状态中,由于CO越大,c(CO)就越大,增大反应物的浓度,可以提高其它反应物的转化率,所以这三点中反应物SO2的转化率最高的是c点;②由于反应CaO(s)+3CO(g)+SO2(g)
。(2)在反应I中,前100 s 内v(CO)=(2-1.1)mol/L÷100s=0.009mol/(L·s),v(SO2)="=" v(CO)=0.009mol/(L·s);平衡时CO的转化率为[(2-0.8)÷2]×100%=60%;(3)若只研究反应II,在不同条件下其反应能量变化如图所示,由于降低了反应的活化能,反应热没有变化,所以图中曲线a到曲线b的措施是加入了催化剂;A.由于反应前后气体的质量发生了变化,而气体的物质的量不变,所以若体系中气体的平均摩尔质量不再改变,则气体的质量不再发生变化,反应达到平衡状态,正确;B.因为在方程式是两种气体的方程式的系数相同,所以在任何时刻都存在v(CO)=v(CO2),因此不能作为判断反应达到平衡的标志,错误;C.反应物CO达到平衡时其的转化率达到了最大限度,正确;D.由于容器的容积不变,反应前后气体的体积相等,所以在任何时刻都存在体系内气体压强不再发生变化,故不能作为判断反应达到平衡状态的标志,错误;(4)①根据图像可知a、b、c三点同一温度下不同的n(CO)开始投入量的所处的平衡状态中,由于CO越大,c(CO)就越大,增大反应物的浓度,可以提高其它反应物的转化率,所以这三点中反应物SO2的转化率最高的是c点;②由于反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H=-394kJ/mol,即该反应是放热反应,升高温度,平衡向逆反应方向移动,CO2体积 分数降低,故T2低于T1。
CaS(s)+3CO2(g)的△H=-394kJ/mol,即该反应是放热反应,升高温度,平衡向逆反应方向移动,CO2体积 分数降低,故T2低于T1。本题所属考点:【化学平衡】
本题难易程度:【困难】
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:一定条件下,对于可逆反应X(g)+3Y.. | ||