|
(10分)工业制氢气的一个重要反应是:CO(g)+H2O(g)<img src="ht【化学平衡】
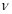 (CO)=_____; (CO)=_____;③实验II条件下反应的平衡常数K=_____________(保留小数点后二位); ④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______; ⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时 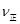 ___________ ___________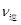 (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”) (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”) 填空题 (10分)工业制氢气的一个重要反应是:CO(g)+H2O(g) | A.容器中CO的含量保持不变 | B.容器中CO2浓度与CO浓度相等 | |||||
C.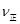 (CO)= (CO)=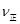 (H2O) (H2O) | D.容器中混合气体的平均相对分子质量保持不变 |
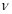 (CO)=_____;
(CO)=_____;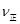 ___________
___________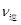 (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)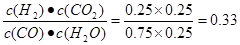 ;④由于在其它条件不变时。增大反应物的浓度可以是其它反应物的转化率提高,而其本身的转化率降低,所以在实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是二者的物质的量的比小于方程式中的计量关系的比,即a<b;⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时由于Q=
;④由于在其它条件不变时。增大反应物的浓度可以是其它反应物的转化率提高,而其本身的转化率降低,所以在实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是二者的物质的量的比小于方程式中的计量关系的比,即a<b;⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时由于Q= ,所以
,所以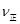 >
>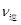 (填“”或“<”),平衡向向正反应方向移动。
(填“”或“<”),平衡向向正反应方向移动。本题所属考点:【化学平衡】
本题难易程度:【困难】
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:COCl2(g) <img src="http.. | ||