|
|
|
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq) <i【化学平衡】
2016-12-26 16:15:06
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)  Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是 Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
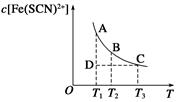
A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为
Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq) ΔH >0 Fe(SCN)2+(aq) ΔH >0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C.反应处于D点时,一定有υ正>υ逆
D.A点与B点相比,A点的c(Fe3+)大
|
选择题 FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)  Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是 Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是

A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为
Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq) ΔH >0 Fe(SCN)2+(aq) ΔH >0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C.反应处于D点时,一定有υ正>υ逆
D.A点与B点相比,A点的c(Fe3+)大
|
本题答案:C
本题解析:
试题分析:A.随着温度的升高c[Fe(SCN)2+]逐渐减小,说明反应放热,△H<0,故A错误;B.反应放热,升高温度平衡向逆反应方向移动,则k减小,所以温度为T1<T2时,反应的平衡常数分别为K1、K2,则K1>K2,故B错误;C.D在曲线下方,不是平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动,V正>V逆,故C正确;D.由图象可知,A点c[Fe(SCN)2+]较大,则c(Fe3+)应较小,故D错误,答案选C。
考点:考查化学平衡图象问题
本题所属考点:【化学平衡】
本题难易程度: 91exam.org【一般】
It is a foolish sheep that makes the wolf his confessor. 笨羊才向狼忏悔。