微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 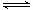 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 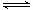 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 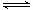 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1来源:91考试网 91EXAm.org
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1来源:91考试网 91EXAm.org
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D 增加CO的浓度 E 分离出二甲醚
(3)反应②2CH3OH(g)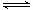 CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验
序号
| 温度
浓度
时间
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 800℃
| c2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| c3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
填空题 (13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 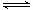 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 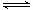 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 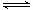 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D 增加CO的浓度 E 分离出二甲醚
(3)反应②2CH3OH(g)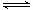 CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验
序号
| 温度
浓度
时间
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 800℃
| c2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| c3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
本题答案:(13分)
(1)3H2(g)+3CO(g)![]() 本题解析:
本题解析:
试题分析:(1)总合成反应的化学方程式为3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g),根据盖斯定律得总反应=①×2+②+③,所以总反应的热化学方程式为3H2(g)+3CO(g)
CH3OCH3(g)+CO2 (g),根据盖斯定律得总反应=①×2+②+③,所以总反应的热化学方程式为3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=-246.4 kJ·mol-1;
CH3OCH3(g)+CO2 (g) ΔH=-246.4 kJ·mol-1;
(2)A、温度升高,平衡逆向移动,CO的转化率降低,错误;B、加入催化剂对平衡无影响,CO的转化率不变,错误;C、减少二氧化碳的浓度,平衡正向移动,CO的 转化率增大,正确;D、增加CO的浓度,虽然平衡正向移动,但是CO的转化率降低,错误;E、分离出二甲醚,生成物浓度减小,平衡正向移动,CO的转化率升高,正确,答案选CE;
(3)①实验1,反应在10至20分钟时间内用CH3OH(g)的浓度减少0.80-0.67=0.13mol/L,所以用甲醇表示的平均速率为0.13mol/L/10min="0.013" mol/(L·min);
②实验2与实验1的温度相同,达到的平衡状态相同,但不同的是达到平衡的时间短,所以实验2中的加成的起始浓度与实验1相同,都是1.0mol/L,实验2的反应速率快,但平衡未改变,所以隐含的条件是实验2使用了催化剂;
③根据表中数据可知实验3平衡时CH3OH(g)浓度大于实验1,则实验3的甲醇的起始浓度大于实验1,反应物浓度增大,反应速率加快,所以v3>v1;2CH3OH(g)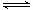 CH3OCH3(g)+H2O(g)是反应前后气体物质的量不变的可逆反应,所以恒温恒容条件下达到的平衡是等效平衡,实验3中甲醇平衡浓度是实验1的0.6/0.5=1.2倍,则起始浓度也是实验1的1.2倍,所以c3=1.2mol/L。
CH3OCH3(g)+H2O(g)是反应前后气体物质的量不变的可逆反应,所以恒温恒容条件下达到的平衡是等效平衡,实验3中甲醇平衡浓度是实验1的0.6/0.5=1.2倍,则起始浓度也是实验1的1.2倍,所以c3=1.2mol/L。
考点:考查化学平衡理论的应用,平衡的计算,等效平衡的判断,盖斯定律的应用
本题所属考点:【化学平衡】
本题难易程度:【一般】
Hide not your light under a bushel. 不要把你的烛光藏在笆斗下。/ 勿过分谦虚,隐藏才能。