微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 (11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2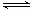 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平 衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)
计算题 (11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2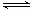 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)
本题答案:(1)50%
(2) 33.33%
(3)&#
本题解析:
试题分析:(1)设氮气的体积减少x,则
N2 + 3 H2 2NH3,
2NH3,
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
则1-x+3-3x+2x=0.75(1+3)解得x=0.5,所以氮气的转化率是0.5/1×100%=50%;
(2)平衡时氨气的体积分数是2×0.5/[0.75×(1+3)] ×100%=33.3%;
(3)根据质量守恒定律,平衡时混合气体的相对分子质量与起始气体的相对分子质量之比等于体积的反比,平衡时混合气体的体积与起始气体的体积比是0.75=3:4,则平衡时混合气体的相对分子质量与起始气体的相对分子质量之比是4:3=4/3.
考点:考查化学平衡的计算
本题所属考点:【化学平衡】
本题难易程度:【一般】
A man can do no more than he can. 凡事应量力而行.