微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (13分)(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
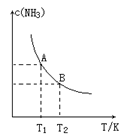
①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:①N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol ②2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
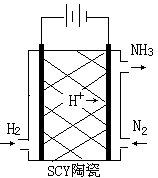
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如右图所示,则阴极的电极反应式是 。
填空题 (13分)(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:①N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol ②2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2( g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如右图所示,则阴极的电极反应式是 。

本题答案:(13分)(1)①>,<。(共2分,各1分)②8.00×10
本题解析:
试题分析:(1)根据图像可知,当温度由T1变化到T2时,c(NH3)降低,所以化学平衡常数减小,因此平衡常数关系K1>K2;该反应的正反应是放热反应,所以△H<0;②N2(g)+3H2(g)=2NH3(g),假设反应过程中N2的物质的量变化了x,则H2变化3x, NH3变化2x,平衡时各种气体的物质的量分别是(1-x)mol、(3-3x)mol;2xmol,由于平衡混合气体中氨气的体积分数为25.0%,所以2x÷(4-2x)=0.25,解得x=0.4mol,所以从反应开始至达到平衡, N2的化学反应速率为(0.4mol÷10L)÷5.00min=0.008mol/(L·Min);③T1温度下该反应的化学平衡常数K1=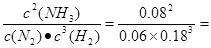
 L2/mol2;(2)根据方程式可知该反应是体系混乱程度增大的反应,所以△S>0;①×2-②×3,整理可得2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(2a-3b)kJ/mol;(3)根据图示可知,在阴极N2得到电子变为NH3,电极反应式是N2+6e—+6H+=2NH3。
L2/mol2;(2)根据方程式可知该反应是体系混乱程度增大的反应,所以△S>0;①×2-②×3,整理可得2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(2a-3b)kJ/mol;(3)根据图示可知,在阴极N2得到电子变为NH3,电极反应式是N2+6e—+6H+=2NH3。
考点:考查化学平衡常数的计算与比较、反应热和焓变、熵变的关系、热化学方程式的书写、电化学的应用的知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
All are not friends that speak us fait. 当面说好话的并不都是朋友.