|
|
|
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2【化学平衡】
2016-12-26 16:35:46
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是
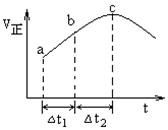
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应 物的总能量低于生成物的总能量
D.若△t1=△t2,则SO2的转化量:a~b段小于b~c段
|
选择题 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是

A.反应在c点达到平衡状态
B .反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.若△t1=△t2,则SO2的转化量:a~b段小于b~c段
|
本题答案:D
本题解析:
试题分析:这是一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响。由图可以看出随着反应的进行正反应速率逐渐增大,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快,所以选项C不正确;但当到达c点后正反应反而降低,这么说此时反应物浓度的影响是主要的,因为反应物浓度越来越小了。但反应不一定达到平衡状态,所以选项A、B均不正确;正反应速率越快,消耗的二氧化硫就越多,因此选项D是正确的,选D。
考点:考查化学平衡图像。
本题所属考点:【化学平衡】
本题难易程度:【一般】
A well-Prepared mind hopes in adversity and fears in prosperity. 遇事有准备的人逢逆境不失望,处顺境不大意。