微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g)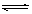 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1 000
|
平衡常数K
| 10
| 9
| 1
| 0.6
|
试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或“吸热”),该反应的平衡常数表达式为 。
(2)能判断该反应是否达到化学平衡 www.91exAm.org状态的依据是 (填序号)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为 .
A.加压,400~500℃ 催化剂 B.加压,830~1000℃ 催化剂
C.常压,400~500℃ 催化剂 D.常压,830~1000℃ 催化剂
(4)在830 ℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10 min后达到平衡时,CO2的平衡浓度为___________,用H2浓度变化来表示的平均反应速率为____________, CO的转化率是_________。
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是___________(填字母序号).
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂
填空题 (16分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g)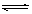 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1 000
|
平衡常数K
| 10
| 9
| 1
| 0.6
|
试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或“吸热”),该反应的平衡常数表达式为 。
(2)能判断该反应是否达到化学平衡状态的依据是 (填序号)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为 .
A.加压,400~500℃ 催化剂 B.加压,830~1000℃ 催化剂
C.常压,400~500℃ 催化剂 D.常压,830~1000℃ 催化剂
(4)在830 ℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10 min后达到平衡时,CO2的平衡浓度为___________,用H2浓度变化来表示的平均反应速率为____________, CO的转化率是_________。
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是___________(填字母序号).
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂
本题答案:(1)放热;K= c( H 2)c(CO2)/c(CO)c(
本题解析:
试题解析:(1)由于温度升高,该反应的化学平衡常数减小,平衡向着逆向移动,正向反应是放热反应;根据反应CO(g)+H2O(g)?H2(g)+CO2(g)及化学平衡常数表达式,K=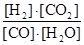 ;(2)反应前后气体体积不变,压强始终不会变化,所以压强不变,无法判断是否达到平衡状态,故a错误;浓度不变,反应达到了化学平衡状态,故b正确;正逆反应速率相等,各组分浓度不变,达到了化学平衡状态,故c正确;浓度相等,不能判断各组分浓度是否不变,无法判断是否达到平衡状态,故d错误;(3)该反 应正向是气体总量不变的放热反应,可在常压及较低的温度下进行,故可选C;(4)设建立平衡时消耗cmol/LCO,则:
;(2)反应前后气体体积不变,压强始终不会变化,所以压强不变,无法判断是否达到平衡状态,故a错误;浓度不变,反应达到了化学平衡状态,故b正确;正逆反应速率相等,各组分浓度不变,达到了化学平衡状态,故c正确;浓度相等,不能判断各组分浓度是否不变,无法判断是否达到平衡状态,故d错误;(3)该反 应正向是气体总量不变的放热反应,可在常压及较低的温度下进行,故可选C;(4)设建立平衡时消耗cmol/LCO,则:
CO(g)+H2O(g)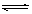 H2(g)+CO2(g)(4)(5)
H2(g)+CO2(g)(4)(5)
初始浓度(mol/L):2 3 0 0
变化浓度(mol/L):c c c c
平衡浓度(mol/L):2-c 3-c c c
则K= =1,解得c=1.2 mol/L,CO2的平衡浓度=1.2 mol/L,用H2浓度变化来表示的平均反应速率=
=1,解得c=1.2 mol/L,CO2的平衡浓度=1.2 mol/L,用H2浓度变化来表示的平均反应速率=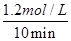 =0.12mol/(L·min), CO的转化率=
=0.12mol/(L·min), CO的转化率= ×100%= 60%;(5)增大CO浓度,可使正反应速率增大且平衡向正向移动,故a正确;升高温度可使正反应速率增大且平衡向逆向移动,故b错误;将生成物分离出去可使逆反应速率减小且平衡向正向移动,故c错误;使用高效催化剂可使正逆反应速率同等程度增大,平衡不移动,故d错误。
×100%= 60%;(5)增大CO浓度,可使正反应速率增大且平衡向正向移动,故a正确;升高温度可使正反应速率增大且平衡向逆向移动,故b错误;将生成物分离出去可使逆反应速率减小且平衡向正向移动,故c错误;使用高效催化剂可使正逆反应速率同等程度增大,平衡不移动,故d错误。
考点:化学平衡
本题所属考点:【化学平衡】
本题难易程度:【困难】
Put all your eggs in one basket--and watch that basket. 把所有的鸡蛋放在一只篮子里,然后看好这只篮子.